题目内容
8.科学家通过探寻矿物X推测外星球上是否曾经存在水.某兴趣小组为分析矿物X中的常见离子,将其溶于稀硝酸,并将所得溶液进行实验,下列依据实验现象得出的结论正确的是( )| A. | 用铂丝蘸取少量溶液进行焰色反应,火焰呈紫色,说明矿物X中含K+ | |
| B. | 取少量溶液向其中滴加NaOH溶液,加热,用湿润红色石蕊试纸检验生成的气体,试纸变蓝,说明矿物X中含NH4+ | |
| C. | 取少量溶液向其中滴加KSCN溶液,溶液变为血红色,说明矿物X中含Fe3+ | |
| D. | 取少量溶液向其中滴加盐酸酸化的BaCl2溶液,有白色沉淀产生,说明矿物X中含SO42- |
分析 A、观察K的焰色反应现象是紫色;
B、铵盐可以和碱溶液之间加热反应生成碱性气体氨气,该气体能使湿润的红色石蕊试纸变蓝;
C、铁离子能和KSCN溶液混合产生血红色溶液,亚铁离子可以被硝酸氧化为铁离子;
D、取少量溶液向其中滴加盐酸酸化的BaCl2溶液,有白色沉淀产生,改沉淀可以是硫酸钡或是氯化银.
解答 解:A、用铂丝蘸取某溶液进行焰色反应,火焰呈紫色,说明该溶液一定存在K+,故A正确;
B、铵盐可以和碱溶液之间只有加热才反应生成碱性气体氨气,该气体能使湿润的红色石蕊试纸变蓝,向某未知溶液中加入稀NaOH溶液,加热,将湿润的红色石蕊试纸靠近试管口,试纸变蓝,说明矿物X中含NH4+,故B正确;
C、铁离子能和KSCN溶液混合产生血红色溶液,所以向某溶液中滴加KSCN溶液,溶液变成血红色,说明该溶液中一定含有Fe3+,但是矿物溶于稀硝酸,出现的铁离子,原来的矿物中不一定含有铁离子,可能含亚铁离子,故C错误;
D、取少量溶液向其中滴加盐酸酸化的BaCl2溶液,有白色沉淀产生,改沉淀可以是硫酸钡或是氯化银,说明矿物X中含SO42-或是Ag+中的至少一种,故D错误.
故选AB.
点评 本题考查离子鉴别题目,做题时注意从题目中找出反应的典型现象,根据物质的性质进行推断即可,难度中等.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
18.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在某密闭容器中加入0.5 molN2和1.5 mol H2,充分反应后有的N-H键数为3NA | |
| B. | 标准状况下,2.24 L SO3含有的原子数为0.4 NA | |
| C. | 71 g氯气与足量铁反应过程中转移的电子数为2NA | |
| D. | NA个Fe3+完全水解可以得到NA个氢氧化铁胶体粒子 |
19.4-甲基-2-乙基-1-戊烯,经加氢后产物的名称是( )
| A. | 2,4-二甲基己烷 | B. | 2,5-二甲基己烷 | ||
| C. | 4-甲基-2-乙基戊烷 | D. | 2-乙基-4-甲基戊烷 |
16.化学反应总是伴随着丰富多彩的颜色的变化,下列说法错误的是( )
| A. | 将Na2O2固体投入滴加了少许酚酞的蒸馏水中,溶液先变红后褪色 | |
| B. | 用玻璃棒蘸取浓硝酸滴加到pH试纸上,试纸先变红后变成白色 | |
| C. | 向胆矾晶体(CuSO4•5H2O)滴加浓硫酸,晶体由蓝色变为黑色 | |
| D. | 将SO2通入品红溶液中,溶液颜色褪去,加热后又变成红色 |
3. Q、R、T、M、W五种短周期元素在周期表中的相对位置如图所示,其中M的原子序数是R的原子序数的2倍.下列说法正确的是( )
Q、R、T、M、W五种短周期元素在周期表中的相对位置如图所示,其中M的原子序数是R的原子序数的2倍.下列说法正确的是( )
 Q、R、T、M、W五种短周期元素在周期表中的相对位置如图所示,其中M的原子序数是R的原子序数的2倍.下列说法正确的是( )
Q、R、T、M、W五种短周期元素在周期表中的相对位置如图所示,其中M的原子序数是R的原子序数的2倍.下列说法正确的是( )| A. | 原子半径大小顺序为r(Q)>r(R)>r(T)>r(M)>r(W) | |
| B. | Q、W的单核离子的核外电子数相等 | |
| C. | 五种元素均能形成氢化物 | |
| D. | W的氢化物水溶液酸性最强,说明W的非金属性在五种元素中最强 |
20.现有几种元素的性质或原子结构如表:
(1)元素X的一种同位素可用来测定一些文物的年代,这种同位素的符号是614C;
(2)画出T的离子结构示意图 ;
;
(3)写出实验室利用浓盐酸和二氧化锰制取单质Z的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(4)由T和Y两种元素组成的一种阴阳离子个数比为1:2的过氧化物,其电子式为 .写出该物质的一种用途作供氧剂
.写出该物质的一种用途作供氧剂
(5)T、Z的最高价氧化物对应的水化物相互反应的化学方程式为NaOH+HClO4=NaClO4+H2O.
| 元素编号 | 元素性质或原子结构 |
| T | 失去一个电子后,形成Ne原子电子层结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其单质之一是空气中主要成分,是最常见的助燃剂 |
| Z | 形成双原子单质分子,黄绿色气体 |
(2)画出T的离子结构示意图
 ;
;(3)写出实验室利用浓盐酸和二氧化锰制取单质Z的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(4)由T和Y两种元素组成的一种阴阳离子个数比为1:2的过氧化物,其电子式为
 .写出该物质的一种用途作供氧剂
.写出该物质的一种用途作供氧剂(5)T、Z的最高价氧化物对应的水化物相互反应的化学方程式为NaOH+HClO4=NaClO4+H2O.
17.下列化学实验事实及其解释或结论都正确的是( )
| A. | 用玻璃棒蘸取新制氯水,滴在pH试纸上,然后与比色卡对照,可测定新制氯水的pH | |
| B. | 向10mL 0.1 mol/L的AgNO3溶液中滴加10滴0.1 mol/L的NaCl溶液,有白色沉淀生成,再向其中滴加0.1 mol/L的KI溶液,沉淀变为黄色,说明相同温度下AgCl溶解度大于AgI的溶解度 | |
| C. | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡,再加入0.5 mL有机物Y,加热,未出现砖红色沉淀,说明Y中不含醛基 | |
| D. | 取少量卤代烃Y在碱性溶液中水解,用硝酸酸化至酸性,再滴加AgNO3溶液,生成淡黄色沉淀,说明卤代烃中含有溴元素 |
18.下列关于SiO2和CO2的说法中不正确的是( )
| A. | CO2和SiO2都能与碱及碱性氧化物反应 | |
| B. | CO2和SiO2都能与水反应生成相应的酸 | |
| C. | CO2和SiO2都能与焦炭反应生成CO | |
| D. | SiO2可用于制光导纤维,干冰可用于人工降雨 |
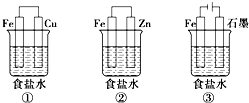 铁、铝及其化合物在生产和生活中有着广泛的应用.某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护.在相同条件下,三组装置中铁电极腐蚀最快的是①(填装置序号),该装置中正极反应式为O2+2H2O+4e-=4OH-;为防止金属Fe被腐蚀,可以采牺牲阳极的阴极保护法的是上述②(填装置序号)装置原理进行防护;装置②的负极反应的电极反应式Zn-2e-=Zn2+;装置③中总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-.
铁、铝及其化合物在生产和生活中有着广泛的应用.某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护.在相同条件下,三组装置中铁电极腐蚀最快的是①(填装置序号),该装置中正极反应式为O2+2H2O+4e-=4OH-;为防止金属Fe被腐蚀,可以采牺牲阳极的阴极保护法的是上述②(填装置序号)装置原理进行防护;装置②的负极反应的电极反应式Zn-2e-=Zn2+;装置③中总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-.