题目内容
常温下,有下列五种溶液:
回答下列问题:
(1)溶液①稀释到原来的10倍后的溶液pH ③溶液的pH(填“>”或“=”或“<”,下同),①和④两溶液中水电离出的c(H+):① ④,④溶液的PH= .
(2)在相同温度时,100mL ②的溶液与10mL ①的溶液相比较,下列数值前者大于后者的是 (填字母).
A.中和时所需NaOH的量 B.电离程度 C.水电离出的c(H+) D.CH3COOH的物质的量
(3)用水稀释⑤时,溶液中随着水量的增加而减小的是 (填字母).
A.C(OH-)/C(NH3?H2O) B.C(NH3?H2O)/C(OH-)C.C(H+)和C(OH-)的乘积 D.OH-的物质的量
(4)联氨(N2H4)溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式: .
| ① | ② | ③ | ④ | ⑤ |
| 0.1mol?L-1 CH3COOH溶液 | 0.01mol?L-1 CH3COOH溶液 | pH=2 CH3COOH溶液 |
0.1mol?L-1 NaOH溶液 |
0.1mol?L-1 氨水 |
(1)溶液①稀释到原来的10倍后的溶液pH
(2)在相同温度时,100mL ②的溶液与10mL ①的溶液相比较,下列数值前者大于后者的是
A.中和时所需NaOH的量 B.电离程度 C.水电离出的c(H+) D.CH3COOH的物质的量
(3)用水稀释⑤时,溶液中随着水量的增加而减小的是
A.C(OH-)/C(NH3?H2O) B.C(NH3?H2O)/C(OH-)C.C(H+)和C(OH-)的乘积 D.OH-的物质的量
(4)联氨(N2H4)溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式:
考点:pH的简单计算,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)①的浓度为0.1mol/L,pH=2的CH3COOH溶液的浓度大于0.01mol/L,稀释到原来的10倍,③的氢离子浓度大;①和④两溶液对水的电离起抑制作用,氢离子或氢氧根离子溶液越大抑制程度越大,水电离出的c(H+)越小;根据氢氧根离子的浓度和水的离子积常数求PH;
(2)在相同温度时,100mL ②的溶液与10mL ①的溶液相比较,
A.两的物质的量,中和时所需NaOH的量相等;
B.越稀越电离,电离程度越大;
C.后者溶液中氢离子浓度大于前者,所以水电离出的c(H+)前者大于后者;
D.CH3COOH的物质的量,因为前者的电离程度小于后者,所以CH3COOH的物质的量前者小于后者;
(3)加水促进氨水的电离,n(OH-)变大,n(NH3?H2O)变小,则
A.C(OH-)/C(NH3?H2O)相当于n(OH-)/n(NH3?H2O)变大;
B.C(NH3?H2O)/C(OH-)相当于n(NH3?H2O)/n(OH-)减小;
C.温度不变,两者C(H+)和C(OH-)的乘积不变;
D.OH-的物质的量变大;
(4)化合物的应用,氨气与水的反应的性质(联氨是一种无色可燃的液体,溶于水显碱性,其原理与氨相似);利用 NH3+H2O?NH4++OH-可以
分析出联氨与水反应的方程式;
(2)在相同温度时,100mL ②的溶液与10mL ①的溶液相比较,
A.两的物质的量,中和时所需NaOH的量相等;
B.越稀越电离,电离程度越大;
C.后者溶液中氢离子浓度大于前者,所以水电离出的c(H+)前者大于后者;
D.CH3COOH的物质的量,因为前者的电离程度小于后者,所以CH3COOH的物质的量前者小于后者;
(3)加水促进氨水的电离,n(OH-)变大,n(NH3?H2O)变小,则
A.C(OH-)/C(NH3?H2O)相当于n(OH-)/n(NH3?H2O)变大;
B.C(NH3?H2O)/C(OH-)相当于n(NH3?H2O)/n(OH-)减小;
C.温度不变,两者C(H+)和C(OH-)的乘积不变;
D.OH-的物质的量变大;
(4)化合物的应用,氨气与水的反应的性质(联氨是一种无色可燃的液体,溶于水显碱性,其原理与氨相似);利用 NH3+H2O?NH4++OH-可以
分析出联氨与水反应的方程式;
解答:
解:(1)①的浓度为0.1mol/L,pH=2的CH3COOH溶液的浓度大于0.01mol/L,稀释到原来的10倍,③的氢离子浓度大;①中0.1mol?L-1 CH3COOH溶液部分电离和④中0.1mol?L-1NaOH溶液完全电离,所以氢氧化钠对水的抑制程度大于醋酸溶 液,所以水电离出氢离子的浓度①>②;c(H+)=
=10-13,所以PH=13,故答案为:>;>;13;
(2)在相同温度时,100mL ②的溶液与10mL ①的溶液相比较,A.两的物质的量,中和时所需NaOH的量相等,故不选;
B.越稀越电离,电离程度越大,故选;
C.后者溶液中氢离子浓度大于前者,所以水电离出的c(H+)前者大于后者,故选;
D.CH3COOH的物质的量,因为前者的电离程度小于后者,所以CH3COOH的物质的量前者小于后者,故不选;
故选B C;
(3)A.C(OH-)/C(NH3?H2O)相当于n(OH-)/n(NH3?H2O)变大;
B.C(NH3?H2O)/C(OH-)相当于n(NH3?H2O)/n(OH-)减小;
C.温度不变,两者C(H+)和C(OH-)的乘积不变;
D.OH-的物质的量变大;故选B;
(4)氨气与水的反应为 NH3+H2O?NH4++OH-
联氨是一种无色可燃的液体,溶于水显碱性,其原理与氨相似即N2H4+H2O?NH2NH3++OH-,进一步反应也可以为NH2NH3++H2O?NH3NH32++OH-,
故答案为:N2H4+H2O?NH2NH3++OH-、( NH2NH3++H2O?NH3NH32++OH-).
| 10-14 |
| 0.1 |
(2)在相同温度时,100mL ②的溶液与10mL ①的溶液相比较,A.两的物质的量,中和时所需NaOH的量相等,故不选;
B.越稀越电离,电离程度越大,故选;
C.后者溶液中氢离子浓度大于前者,所以水电离出的c(H+)前者大于后者,故选;
D.CH3COOH的物质的量,因为前者的电离程度小于后者,所以CH3COOH的物质的量前者小于后者,故不选;
故选B C;
(3)A.C(OH-)/C(NH3?H2O)相当于n(OH-)/n(NH3?H2O)变大;
B.C(NH3?H2O)/C(OH-)相当于n(NH3?H2O)/n(OH-)减小;
C.温度不变,两者C(H+)和C(OH-)的乘积不变;
D.OH-的物质的量变大;故选B;
(4)氨气与水的反应为 NH3+H2O?NH4++OH-
联氨是一种无色可燃的液体,溶于水显碱性,其原理与氨相似即N2H4+H2O?NH2NH3++OH-,进一步反应也可以为NH2NH3++H2O?NH3NH32++OH-,
故答案为:N2H4+H2O?NH2NH3++OH-、( NH2NH3++H2O?NH3NH32++OH-).
点评:本题考查pH的计算及溶液的稀释,明确浓度与pH的换算、酸碱的强弱是解答本题的关键该题综合性很强,需要对各种知识掌握全面、知识的综合利用,对于离子反应.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案
相关题目
如图各装置中,能形成原电池的是( )

| A、①中液体为FeCl3溶液 |
| B、②中液体为酒精 |
| C、③中液体为H2SO4溶液 |
| D、④中液体为稀盐酸 |

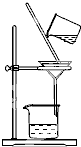 如图所示是粗盐提纯实验操作步骤,其名称为
如图所示是粗盐提纯实验操作步骤,其名称为