题目内容
19.将纯锌片和纯铜片按图示方式插入同浓度同体积的稀硫酸中 一段时间,以下叙述正确的是( )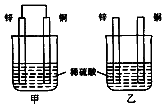
| A. | 两烧杯中铜片表面均无气泡产生 | |
| B. | 两烧杯中溶液的pH均增大 | |
| C. | 甲中电子通过导线由锌片流向铜片,再回到锌片 | |
| D. | 乙中产生气泡的速度比甲快 |
分析 甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑.乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析.
解答 解:A.甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;
B.甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,则两烧杯中溶液的pH均增大,故B正确;
C.原电池中电子从负极流向正极,即从锌流向铜,氢离子在铜上得电子,故C错误.
D.构成原电池的反应速率大于发生化学腐蚀的反应速率,所以产生气泡的速度甲比乙快,故D错误.
故选B.
点评 本题考查了原电池原理,根据原电池构成条件、原电池正负极上发生的反应等知识点分析解答,题目难度不大,明确原电池的原理以及电极反应是解题的关键,侧重于考查学生的分析能力和应用能力.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
9.下列各组物质中,所含分子数一定相同的是( )
| A. | 1 g H2和8 g O2 | |
| B. | 常温常压下,28 g CO和6.02×1022个CO分子 | |
| C. | 0.1 mol HCl和2.24 L He | |
| D. | 150℃、1.01×105 Pa时,18 L H2O和18 L CO2 |
10.下列说法不正确的是( )
| A. | 用胆矾炼铜、烧结粘土制陶瓷都涉及化学变化 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 食盐、醋酸、氨水和硫酸钡都是电解质 | |
| D. | 胶体区别其它分散系的本质特征是分散质微粒直径在lnm〜l00nm之间 |
7. 如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
 如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )| A. | 右边电极上生成物质的质量:①=② | |
| B. | 两级上产生气体的体积:①<② | |
| C. | 溶液的pH变化:①增大,②不变 | |
| D. | 电极反应式:①中阳极2H2O-4e-=4H++O2↑②中负极2H+-2e-=H2↑ |
14.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol•L-1 NaHCO3溶液:K+、Fe3+、Cl-、NO3- | |
| B. | 使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Na+ | |
| C. | 常温下由水电离出的c(H+)=1×10-13mol•L-1的溶液中:Mg2+、Na+、SO32-、NO3- | |
| D. | 常温下在c(H+)=1×10-13mol•L-1的溶液中:Na+、K+、SO42-、CO32- |
11.下列关于SiO2的说法正确的是( )
| A. | SiO2不溶于水,因此不属于酸性氧化物 | |
| B. | CO2通入水玻璃中可得硅酸,说明碳酸酸性大于硅酸 | |
| C. | SiO2是酸性氧化物,它不溶于任何酸 | |
| D. | SiO2晶体由SiO2分子构成,1个Si原子连接2个O原子 |


 .检验该离子常用KSCN溶液.丙的外围电子排布式为3d104s1,在元素周期表中的位置为第四周期ⅠB族.
.检验该离子常用KSCN溶液.丙的外围电子排布式为3d104s1,在元素周期表中的位置为第四周期ⅠB族.