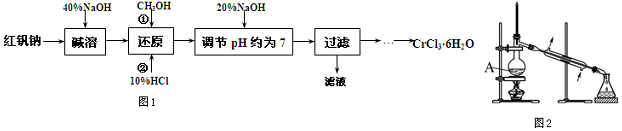
题目内容
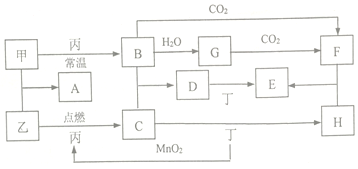
8.A、B、C是单质,其中A是金属,各种物质间的转化关系如图(略去部分反应物和生成物):
(1)写出下列物质的化学式:甲Al2O3丙H2O
(2)写出下列变化的反应方程式.
①A与NaOH溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑
②乙溶液中通入少量CO2反应的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36L,则消耗的A的质量为2.7g.
分析 A、B、C是单质,其中A是金属,A、甲均与NaOH反应,可知A为Al,B为O2,甲为Al2O3,Al与NaOH反应生成乙为偏铝酸钠,C为H2,丙为H2O,乙与二氧化碳反应生成丁为Al(OH)3,以此来解答.
解答 解:(1)由上述分析可知,甲为Al2O3,丙为H2O,故答案为:Al2O3;H2O;
(2)①A与NaOH溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
②乙溶液中通入少量CO2反应的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
(3)产生的C在标准状况下的体积为3.36L,由电子守恒可知参加反应的A为$\frac{3.36L}{22.4L/mol}$×2×$\frac{(1-0)}{(3-0)}$×27g/mol=2.7g,故答案为:2.7g.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应、相互转化为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,A、甲与NaOH反应为推断的突破口,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.将纯锌片和纯铜片按图示方式插入同浓度同体积的稀硫酸中 一段时间,以下叙述正确的是( )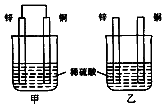

| A. | 两烧杯中铜片表面均无气泡产生 | |
| B. | 两烧杯中溶液的pH均增大 | |
| C. | 甲中电子通过导线由锌片流向铜片,再回到锌片 | |
| D. | 乙中产生气泡的速度比甲快 |
16.(1)一定温度下,Ksp[Mg3(PO3)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26.向浓度均为0.20mol/L的MgCl2和CaCl2混合溶液中逐滴加人Na3PO 4,先生成Mg3(PO4)2沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c=10-4mol/L.
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:
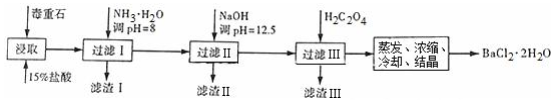
①毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.
②加入NH3•H2O调节PH=8可除去Fe3+(填离子符号),滤渣II中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少.
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL0.01mol/LNa2SO4溶液,下列叙述正确的是D
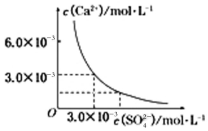
A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀.溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大.
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:

①毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.
②加入NH3•H2O调节PH=8可除去Fe3+(填离子符号),滤渣II中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少.
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL0.01mol/LNa2SO4溶液,下列叙述正确的是D

A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀.溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大.
3.下列事实可以说明甲烷分子具有正四面体结构,而不是正方形的平面结构,理由是( )
| A. | CH4没有同分异构体 | B. | CH3Cl没有同分异构体 | ||
| C. | CH2Cl2没有同分异构体 | D. | CCl4没有同分异构体 |
20.常温下,下列说法正确的是( )
| A. | pH=10的CH3COONa溶液中,水电离产生的c(OH-)=1×10-10mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍(溶液体积变为原来10倍)后,其pH=b,则a=b+1 | |
| C. | pH=3的H2S溶液与pH=11的NaOH溶液任意比例混合:C(Na+)+c(H+)=c(OH-)+c(HS-) | |
| D. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的:c(Na+)大小顺序为 ①>②>③ |
17.已知某溶液中存在较多的H+、SO42-、NO3-,该溶液中还可能大量存在的离子组是( )
| A. | Na+、NH4+、Cl+ | B. | Mg2+、Ba2+、Br- | C. | Mg2+、Cl-、Fe2+ | D. | K+、SiO32-、Cl- |
18.下列化合物中,可以通过置换反应一步得到的是( )
①FeSO4 ②NaOH ③Fe3O4 ④Al2O3.
①FeSO4 ②NaOH ③Fe3O4 ④Al2O3.
| A. | ①②③④ | B. | ①②③ | C. | ①④ | D. | ①③ |
 .
.