题目内容
11.下列关于SiO2的说法正确的是( )| A. | SiO2不溶于水,因此不属于酸性氧化物 | |
| B. | CO2通入水玻璃中可得硅酸,说明碳酸酸性大于硅酸 | |
| C. | SiO2是酸性氧化物,它不溶于任何酸 | |
| D. | SiO2晶体由SiO2分子构成,1个Si原子连接2个O原子 |
分析 A、二氧化硅与氢氧化钠反应生成盐与水;
B、强酸制弱酸进行判断;
C、二氧化硅溶于氢氟酸;
D、SiO2是原子晶体由原子构成,1个Si原子连接4个O原子.
解答 解:A、二氧化硅与氢氧化钠反应生成盐与水,所以二氧化硅是酸性氧化物,故A错误;
B、CO2通入水玻璃中可得硅酸,说明碳酸酸性强于硅酸,故B正确;
C、二氧化硅溶于氢氟酸,不是不溶于任何酸,故C错误;
D、SiO2是原子晶体由原子构成,1个Si原子连接4个O原子,而不是两个氧原子,故D错误;
故选B.
点评 本题主要考查了原子晶体的结构,难度不大,掌握原子晶体的结构是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列离子方程式书写不正确的是( )
| A. | 将H2S气体通入Fecl3溶液中:H2S+2Fe3+=2Fe2++S↓+2H+ | |
| B. | Si与NaOH溶液反应:Si+2OH-+H2O=SiO32-+2H2↑ | |
| C. | 将Cl2和SO2体积比1:1同时通入水中:Cl2+SO2+2H2O=4H++SO42-+2Cl- | |
| D. | 将CO2气体通入饱和Na2CO3溶液中:CO2+H2O+CO32-=2HCO3- |
2.下列说法正确的是( )
| A. | 盐酸、氨水、碱石灰都是混合物 | |
| B. | 将Na单质长时间的放置于空气中,最终得到的白色固体是NaHCO3 | |
| C. | SiO2不能溶于水生成H2Si03,因此SiO2不是酸性氧化物 | |
| D. | 用焰色反应检验Na+之前,应用稀硫酸清洗铁丝,并在火焰上灼烧至无色 |
19.将纯锌片和纯铜片按图示方式插入同浓度同体积的稀硫酸中 一段时间,以下叙述正确的是( )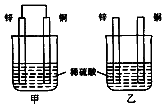

| A. | 两烧杯中铜片表面均无气泡产生 | |
| B. | 两烧杯中溶液的pH均增大 | |
| C. | 甲中电子通过导线由锌片流向铜片,再回到锌片 | |
| D. | 乙中产生气泡的速度比甲快 |
6.下列各组物质中,前者为电解质,后者为非电解质的是( )
| A. | 硫酸,硫酸钡 | B. | NH3,氢氧化钠 | C. | 盐酸,醋酸 | D. | 食盐,酒精 |
16. 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
(1)将浓度为0.1mol/LHF溶液加水稀释一倍(假设温度不变),下列各量减小的是A.
A.c(H+) B.c(H+)•c(OH-) C.c(H+)/c(HF) D.c(OH-)/c(H+)
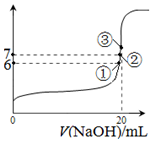
(2)25℃时,在20mL0.1mol•L-1氢氟酸中加入VmL0.1mol•L-1NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是BC.
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时pH=7,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol•L-1
(3)物质的量浓度均为0.1mol/L的下列四种溶液:①Na2CO3溶液②NaHCO3溶液③NaF溶液④NaClO溶液,pH由大到小的顺序是①>④>②>③(用序号表示).
(4)Na2CO3水解的化学方程式Na2CO3+H2O?NaHCO3+NaOH
(5)简要说明NaHCO3溶液显碱性的原因HCO3-的水解程度大于HCO3-的电离程度.
 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
A.c(H+) B.c(H+)•c(OH-) C.c(H+)/c(HF) D.c(OH-)/c(H+)
(2)25℃时,在20mL0.1mol•L-1氢氟酸中加入VmL0.1mol•L-1NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是BC.
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时pH=7,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol•L-1
(3)物质的量浓度均为0.1mol/L的下列四种溶液:①Na2CO3溶液②NaHCO3溶液③NaF溶液④NaClO溶液,pH由大到小的顺序是①>④>②>③(用序号表示).
(4)Na2CO3水解的化学方程式Na2CO3+H2O?NaHCO3+NaOH
(5)简要说明NaHCO3溶液显碱性的原因HCO3-的水解程度大于HCO3-的电离程度.
3.下列化学反应的速率,前者一定大于后者的是( )
| A. | 相同温度下,颗粒大小相同的锌粒分别与pH值相同的硫酸和盐酸反应 | |
| B. | A+B$\stackrel{500℃}{→}$C;D+E$\stackrel{100℃}{→}$F | |
| C. | 相同温度下,与同浓度盐酸反应的锌粒和铁粉 | |
| D. | G+H→W+Q(Q>0),其他条件相同时分别在200℃和100℃时反应 |
20.常温下,下列说法正确的是( )
| A. | pH=10的CH3COONa溶液中,水电离产生的c(OH-)=1×10-10mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍(溶液体积变为原来10倍)后,其pH=b,则a=b+1 | |
| C. | pH=3的H2S溶液与pH=11的NaOH溶液任意比例混合:C(Na+)+c(H+)=c(OH-)+c(HS-) | |
| D. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的:c(Na+)大小顺序为 ①>②>③ |
 .
.