题目内容
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
(1)肼的结构式为 .
(2)肼燃料电池原理如图1所示,左边电极上发生的电极反应式 .
(3)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ?mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: .
(4)联氨的工业生产常用氨和次氯酸钠为原料获得,也可在催化剂作用下,用尿素[CO(NH2)2]和次氯酸钠与氢氧化钠的混合溶液反应获得,尿素法反应的离子方程式为 .
(5)如图2所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同且均为a L.
①B中可通过观察 判断可逆反应2NO2?N2O4已经达到平衡.
②若平衡后在A容器中再充入0.5mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数 (填“变大”“变小”或“不变”).
③若容器A中到达平衡所需时间为t s,达到平衡后容器内压强为起始压强的.8倍,则平均化学反应速率v(NO2)等于 .
④若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为 L.
(1)肼的结构式为
(2)肼燃料电池原理如图1所示,左边电极上发生的电极反应式
(3)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ?mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
(4)联氨的工业生产常用氨和次氯酸钠为原料获得,也可在催化剂作用下,用尿素[CO(NH2)2]和次氯酸钠与氢氧化钠的混合溶液反应获得,尿素法反应的离子方程式为
(5)如图2所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同且均为a L.
①B中可通过观察
②若平衡后在A容器中再充入0.5mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数
③若容器A中到达平衡所需时间为t s,达到平衡后容器内压强为起始压强的.8倍,则平均化学反应速率v(NO2)等于
④若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为

考点:化学平衡的计算,离子方程式的书写,用盖斯定律进行有关反应热的计算,原电池和电解池的工作原理
专题:
分析:(1)肼又称做连氨,由两个氨基相连;
(2)左端为负极,在碱性电解质中失去电子生成氮气和水;
(3)利用盖斯定律来计算2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)的反应热;
(4)在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,结合质量守恒定律来书写离子反应方程式;
(5)①反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化;
②根据压强对化学平衡的移动的影响因素来回答;
③根据反应前后气体的压强之比等于物质的量之比来回答;
④根据等效平衡分析.
(2)左端为负极,在碱性电解质中失去电子生成氮气和水;
(3)利用盖斯定律来计算2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)的反应热;
(4)在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,结合质量守恒定律来书写离子反应方程式;
(5)①反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化;
②根据压强对化学平衡的移动的影响因素来回答;
③根据反应前后气体的压强之比等于物质的量之比来回答;
④根据等效平衡分析.
解答:
解:(1)肼由两个氨基相连而成,结构式为 ,故答案为:
,故答案为: ;
;
(2)左端为负极,在碱性电解质中失去电子生成氮气和水,电极反应为N2H4-4e-+4OH-=N2+4H2O,故答案为:N2H4-4e-+4OH-=N2+4H2O;
(3)由N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ?mol-1 ①
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1 ②
2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1 ③
根据盖斯定律可知②×2-①-③得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),
△H=(-534.0kJ?mol-1)×2-(-67.7kJ?mol-1)-(-52.7kJ?mol-1)=-947.6 kJ?mol-1,
即热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-947.6 kJ?mol-1,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-947.6 kJ?mol-1;
(4)由在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,根据质量守恒定律可知两种盐为氯化钠和碳酸钠,该反应为CO(NH2)2+ClO-+2OH-=N2H4+CO32-+Cl-+H2O,
故答案为:CO(NH2)2+ClO-+2OH-=N2H4+CO32-+Cl-+H2O;
(5)①B是一个气体压强不变的容器,所以当反应达到平衡状态时,混合气体的颜色和气囊体积不再改变,故答案为:气囊B的体积不再减小或气体颜色不再变化;
②再加入气体,相当于增大压强,化学平衡正向移动,二氧化氮的百分含量会减小,故答案为:变小;
③2NO2?N2O4
起始(mol):1 0
变化(mol):2 x
平衡(mol):1-2x x
则
=0.8,解得x=0.2mol,所以平均化学反应速率v(NO2)=
mol/(L?s)=
mol/(L?s),故答案为:
mol/(L?s);
④打开K2,则相当于是在等温等压时的平衡,因此平衡时等效的.由于此时反应物的物质的量是B中的二倍,所以打开K2之前,气球B体积为(aL+0.4aL)÷2=0.7aL,
故答案为:0.7a.
 ,故答案为:
,故答案为: ;
; (2)左端为负极,在碱性电解质中失去电子生成氮气和水,电极反应为N2H4-4e-+4OH-=N2+4H2O,故答案为:N2H4-4e-+4OH-=N2+4H2O;
(3)由N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ?mol-1 ①
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1 ②
2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1 ③
根据盖斯定律可知②×2-①-③得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g),
△H=(-534.0kJ?mol-1)×2-(-67.7kJ?mol-1)-(-52.7kJ?mol-1)=-947.6 kJ?mol-1,
即热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-947.6 kJ?mol-1,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-947.6 kJ?mol-1;
(4)由在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,根据质量守恒定律可知两种盐为氯化钠和碳酸钠,该反应为CO(NH2)2+ClO-+2OH-=N2H4+CO32-+Cl-+H2O,
故答案为:CO(NH2)2+ClO-+2OH-=N2H4+CO32-+Cl-+H2O;
(5)①B是一个气体压强不变的容器,所以当反应达到平衡状态时,混合气体的颜色和气囊体积不再改变,故答案为:气囊B的体积不再减小或气体颜色不再变化;
②再加入气体,相当于增大压强,化学平衡正向移动,二氧化氮的百分含量会减小,故答案为:变小;
③2NO2?N2O4
起始(mol):1 0
变化(mol):2 x
平衡(mol):1-2x x
则
| (1-2x)+x |
| 1 |
| 0.2×2 |
| at |
| 0.4 |
| at |
| 0.4 |
| at |
④打开K2,则相当于是在等温等压时的平衡,因此平衡时等效的.由于此时反应物的物质的量是B中的二倍,所以打开K2之前,气球B体积为(aL+0.4aL)÷2=0.7aL,
故答案为:0.7a.
点评:本题考查了化学平衡的计算和盖斯定律等知识点,难点是根据等效平衡进行计算,难度较大.

练习册系列答案
相关题目
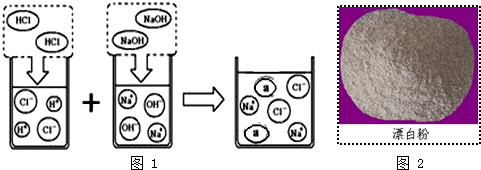
下列有关四个常用电化学装置的叙述正确的是( )


| A、图Ⅰ所示电池中,MnO2作催化剂 |
| B、图Ⅱ所示电池放电过程中,硫酸浓度不断增大 |
| C、图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变 |
| D、图Ⅳ所示电池中,Ag2O作氧化剂,在电池工作过程中被还原为Ag |
下列说法不正确的是( )
| A、为了提高生活用水的卫生标准,自来水厂常同时使用Cl2和FeSO4?7H2O进行消毒、净化,以改善水质 |
| B、铝表面有一层致密的氧化薄膜,故铝制容器可用来腌制咸菜等 |
C、 从分类的角度看,混合物、分散系、胶体的从属关系如图所示: |
| D、借助扫描隧道显微镜,应用STM技术可实现对原子或分子的操纵 |
下列有关说法正确的是( )


| A、常温下,向20mL0.1mol?L-1酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图1,则当VNaOH=10mL时,溶液中存在2C(Na+)=C(H2T)+C(HT-)+C(T2-) | ||
| B、用0.0100mol?L-1硝酸银标准溶液,滴定浓度均为0.100mol?L-1的 Cl-、Br-及I-的混合溶液,由图2曲线,可确定首先沉淀的是Cl- | ||
C、已知25℃、101kPa时:①2Na(s)+
| ||
| D、由图3可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行 |
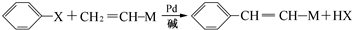 (X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下:
(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下: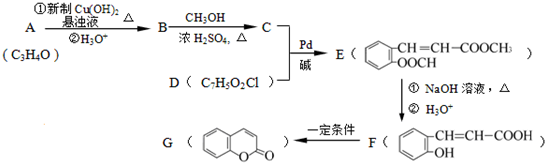
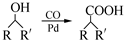 (R,R′为烃基),试写出以苯和丙烯(CH2═CH-CH3)为原料,合成
(R,R′为烃基),试写出以苯和丙烯(CH2═CH-CH3)为原料,合成 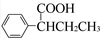 的路线流程图(无机试剂任选).合成路线流程图示例如下:H2C═CH2
的路线流程图(无机试剂任选).合成路线流程图示例如下:H2C═CH2