题目内容
14.为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如表,t表示收集a mL O2所需的时间.
| 序号 | 反应 温度/℃ | c(H2O2)/ mol•L-1 | V(H2O2) /mL | m(MnO2) /g | t/min |
| 1 | 20 | 2 | 10 | 0 | t1 |
| 2 | 20 | 2 | 10 | 0.1 | t2 |
| 3 | 20 | 4 | 10 | 0.1 | t3 |
| 4 | 40 | 2 | 10 | 0.1 | t4 |
(2)为研究温度对化学反应速率的影响,可以将实验2和实验4作对比(填序号).
(3)将实验1和实验2作对比,t1>t2(填“>”、“<”或“=”).
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-?2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:
①0.1mol•L-1 KI溶液 ②0.1mol•L-1 FeCl3溶液 ③0.1mol•L-1 FeCl2溶液 ④0.1mol•L-1 盐酸 ⑤0.1mol•L-1KSCN溶液 ⑥CCl4
实验步骤:(1)取5mL 0.1mol•L-1 KI溶液,再滴加几滴0.1mol•L-1 FeCl3溶液;
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂⑤(填序号),现象溶液显血红色,说明此反应存在一定的限度.
Ⅲ.N2O4可分解为NO2.在100mL密闭容器中投入0.01mol N2O4,利用现代化学实验技术跟踪测量c(NO2).c(NO2)随时间变化的数据记录如图所示.

(1)反应容器中最后剩余的物质有N2O4和NO2,其中N2O4的物质的量为0.004mol.
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,最后不变.
分析 Ⅰ.(1)实验2和实验3主要是双氧水的浓度不同;
(2)实验2和实验4其他条件都相同,只有温度不同;
(3)试验1和实验2相比较,2中使用了催化剂,其他条件相同;
Ⅱ.(4)加入0.1mol•L-1 KSCN溶液,如果溶液出现血红色,说明溶液中有没反应的FeCl3溶液,说明此反应为可逆反应;
Ⅲ.(1)因为N2O4(g)?2NO2为可逆反应,反应达平衡时,反应容器中最后剩余的物质有NO2、N2O4;再根据平衡图象计算N2O4的物质的量;
(2)达到平衡状态时,正反应速率与逆反应速率相等,保持不变.
解答 解:Ⅰ.(1)实验2和实验3主要是双氧水的浓度不同,则实验目的为研究双氧水浓度不同,对化学反应速率的影响,
故答案为:H2O2的浓度;
(2)实验2和实验4其他条件都相同,只有温度不同,
故答案为:2;4;
(3)试验1和实验2相比较,2中使用了催化剂,其他条件相同,反应速率大,所用时间短,
故答案为:>;
Ⅱ.(4)加入0.1mol•L-1 KSCN溶液,如果溶液出现血红色,说明溶液中有没反应的FeCl3溶液,说明此反应为可逆反应,存在一定的限度,
故答案为:⑤;溶液出现血红色;
Ⅲ.(1)因为N2O4(g)?2NO2为可逆反应,反应达平衡时,反应容器中最后剩余的物质有NO2、N2O4;平衡时,n(NO2)=0.12mol/L×0.1L=0.012mol,则N2O4的物质的量为0.01mol-0.006mol=0.004mol,
故答案为:NO2、N2O4;0.004mol;
(2)达到平衡状态时,正反应速率与逆反应速率相等,保持不变,
故答案为:不变.
点评 本考点主要考查了影响化学反应速率的因素的探究,要好好利用控制变量法,化学反应速率中的计算,化学平衡的建立,三价铁离子的检验都属于基础知识的考查,注意灵活运用.

| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 还原性 H2T>H2R | |
| B. | 单质与稀盐酸反应的速率为L<Q | |
| C. | M与T形成的化合物能与NaOH溶液反应 | |
| D. | L2+与R2-的核外电子数相等 |
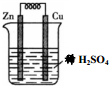
| A. | 铜片是正极 | B. | 锌片质量逐渐减少 | ||
| C. | 电子从锌片经溶液流向铜片 | D. | 正极的电极反应式:2H++2e-=H2↑ |
| A. | SO2通入溴水中:SO2+2H2O+Br2═2H++SO42-+2HBr | |
| B. | 向漂白粉稀溶液中通入过量CO2:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | NaHSO4溶液和Ba(OH)2溶液充分反应后溶液显中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
| A. | MgSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 0.3molFeBr2与0.4molCl2在溶液中反应:8Cl2+6Fe2++10Br-═6Fe3++16Cl-+5Br2 | |
| C. | Cu与稀HNO3反应:Cu+4H++2NO3-═Cu2++2NO↑+2H2O | |
| D. | AgCl固体溶于足量氨水:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O |
| A. | 是天然气的主要成分 | B. | 能使溴的四氯化碳溶液褪色 | ||
| C. | 除去甲烷中的乙烯用酸性高锰酸钾 | D. | 不能发生加聚反应 |
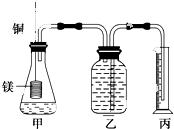 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下: