题目内容
9.下列有机反应中,不属于取代反应的是( )| A. | 乙醇与乙酸的反应 | |
| B. | 蛋白质的水解反应 | |
| C. | 苯和浓硝酸、浓硫酸混合液在50-60℃水浴中发生的反应 | |
| D. | 乙烯使溴水褪色 |
分析 根据有机化合物分子里的某些原子或原子团被其它原子或原子团所代替的反应是取代反应来解答.
解答 解:A.乙酸与乙醇在浓硫酸作用下加热反应发生酯化反应,酯化反应属于取代反应,故A不选;
B.水解反应属于取代反应类型之一,蛋白质的水解属于取代反应,故B不选;
C.苯和浓硝酸、浓硫酸在50-60℃水浴中加热反应发生硝化反应,属于取代反应,故C不选;
D.乙烯含有C=C双键,与溴发生加成反应,使溴的四氯化碳溶液褪色,故D选;
故选D.
点评 本题考查了有机反应类型,难度不大,注意这几个反应之间的区别,根据定义来分析解答即可.

练习册系列答案
相关题目
19.解释下列事实的方程式不正确的是( )
| A. | Al溶于NaOH溶液:2Al+2H2O+2NaOH═2NaAlO2+3H2↑ | |
| B. | 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| C. | 向FeCl3溶液中滴加淀粉碘化钾溶液,溶液变蓝:2Fe3++2I-═2Fe2++I2 | |
| D. | 红热的Fe丝与水接触,表面形成蓝黑色保护层:2Fe+3H2O(g) $\frac{\underline{\;\;△\;\;}}{\;}$ Fe2O3+3H2↑ |
20.下列选项正确的是( )
| A. | 通常用来衡量一个国家的石油化学工业发展水平的标志是石油产量 | |
| B. | 只要存在离子键的化合物就是离子化合物 | |
| C. | NH3的电子式为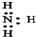 | |
| D. | 原电池中活泼的金属做正极 |
17.表示0.1mol/LNaHCO3溶液中有关微粒浓度的关系式中正确的是( )
| A. | c (Na+)>c (HCO3-)>c (CO32-)>c(H+)>c(OH-) | |
| B. | c (Na+)=c (HCO3-)+c (CO32-)+c (H2CO3) | |
| C. | c (Na+)=c (HCO3-) | |
| D. | c (Na+)+c(H+)=c (HCO3-)+2c (CO32-)+c(OH-)+c(H2CO3) |
14.下表是元素周期表的一部分,回答下列问题:
(1)写出①、③两种元素形成的化合物有两种,其化学式分别为:CO,CO2.
(2)写出①元素最高价氧化物的电子式和结构式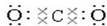 ,O=C=O.
,O=C=O.
(3)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;能形成两性氢氧化物的元素是Al.
(4)序号④⑤⑪的元素组成的化合物为NaClO,写出电子式 .
.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
(2)写出①元素最高价氧化物的电子式和结构式
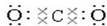 ,O=C=O.
,O=C=O.(3)这些元素的最高价氧化物的对应水化物中HClO4酸性最强;NaOH碱性最强;能形成两性氢氧化物的元素是Al.
(4)序号④⑤⑪的元素组成的化合物为NaClO,写出电子式
 .
.
1.下表中实验操作、现象以及所得出的结论都正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向盛有2mL0.1mol/L AgNO3溶液的试管中,先滴加几滴0.1mol/L KCl溶液,再滴加0.1mol/L KI溶液 | 先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 将适量CO2和SO2分别通入装有Ba(NO3)2溶液的两支试管中 | 一支试管出现白色沉淀,另一支试管无明显现象 | 出现的白色沉淀是BaSO3 |
| C | 取少量KClO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液 | 产生白色沉淀 | KClO3中含Cl- |
| D | 湿润的KI淀粉试纸靠近气体Y | 试纸变蓝 | Y可能是Cl2 |
| A. | A | B. | B | C. | C | D. | D |
3.A元素最高正价和负价绝对值之差为6,B元素次外层有8个电子,BA2在水溶液中能电离出相同电子层结构的离子,则BA2是( )
| A. | CaCl2 | B. | CaF2 | C. | NO2 | D. | CO2 |
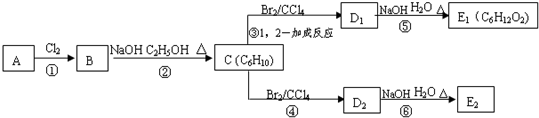
 .
.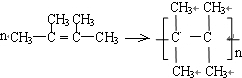 .
.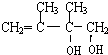 ;C的系统名称是2,3-二甲基-1,3丁二烯.
;C的系统名称是2,3-二甲基-1,3丁二烯. .
.