题目内容
1.如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L.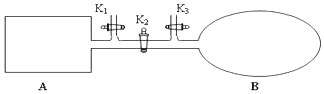
(1)B中除了可通过观察混合气颜色不变的现象判断可逆反应2NO2?N2O4已经达到平衡外,还可通过气囊不再变小的现象进行判断.
(2)若平衡后在A容器中再充入0.5molNO2,则重新到达平衡,新平衡与旧平衡相比,下列物理量减小的有BD;
A.c(NO2) B.NO2的体积分数 C.NO2的转化率 D.$\frac{c(N{O}_{2})}{c({N}_{2}{O}_{4})}$
若平衡后在B容器中再充入0.5mol NO2,则重新到达平衡,新平衡与旧平衡相比,下列物理量增大的有D.
A.NO2的转化率 B.混合气体的平均相对分子质量 C.$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$ D.n(NO2)
(3)若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率υ(NO2)等于$\frac{0.4}{at}$mol/(L•s).
(4)若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为0.7aL.
分析 (1)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化;
(2)若平衡后在A容器中再充入0.5molNO2,则重新到达平衡,新平衡与旧平衡相比压强增大,平衡正向进行,根据压强对化学平衡的移动的影响因素来回答.若平衡后在B容器中再充入0.5mol NO2,则重新到达平衡,新平衡与旧平衡相比达到相同平衡状态;
(3)反应前后气体的压强之比等于物质的量之比来回答;
(4)结合等效平衡分析,打开K2,则相当于是在等温等压时的平衡,因此平衡是等效的.
解答 解:(1)B是一个气体压强不变的容器,所以当反应达到平衡状态时,混合气体的颜色和气囊体积不再改变,说明浓度不变,反应达到平衡状态,
故答案为:气囊不再变小;
(2)反应2NO2?N2O4已经达到平衡,若平衡后在A容器中再充入0.5molNO2,相当于增大压强,平衡正向进行,再加入气体,相当于增大压强,化学平衡正向移动,二氧化氮的百分含量会减小,
A.c(NO2)增大,故A错误;
B.平衡正向进行NO2的体积分数减小,故B正确;
C.平衡正向进行NO2的转化率增大,故C错误;
D.平衡正向进行$\frac{c(N{O}_{2})}{c({N}_{2}{O}_{4})}$比值减小,故D正确;
故选BD.
若平衡后在B容器中再充入0.5mol NO2,则重新到达平衡,新平衡与旧平衡相比达到相同的平衡状态,
A.达到相同的平衡状态,NO2的转化率不变,故A错误;
B.气体质量和物质的量都不变,混合气体的平均相对分子质量不变,故B错误;
C.$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$ 比值不变,故C错误;
D.加入二氧化氮,二氧化氮气体物质的量n(NO2)增大,故D正确;
故选D,
故答案为:BD;D;
(3)2NO2?N2O4
初始物质的量:1 0
变化的物质的量:2x x
平衡物质的量:1-2x x
则$\frac{1-2x+x}{1}$=0.8,解得x=0.2mol,
所以平均化学反应速率v(NO2)=$\frac{0.2×2}{at}$mol/(L•s)=$\frac{0.4}{at}$mol/(L•s),
故答案为:$\frac{0.4}{at}$mol/(L•s);
(4)打开K2,则相当于是在等温等压时的平衡,因此平衡时等效的.由于此时反应物的物质的量是B中的二倍,所以打开K2之前,气球B体积为(aL+0.4aL)÷2=0.7aL,
故答案为:0.7a.
点评 本题考查了化学平衡的计算等知识点,难点是根据等效平衡进行计算,题目难度中等.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案| A. | 电解得到的 Cu 的物质的量为 0.5 mol | |
| B. | 向电解后的溶液中加入 98 g 的 Cu(OH)2 可恢复为原溶液 | |
| C. | 原混合溶液中 c(K+)=4 mol/L | |
| D. | 电解后溶液中 c(H+)=2 mol/L |
| A. | FeCl3具有强氧化性,使血液中的蛋白质被氧化凝固止血 | |
| B. | FeCl3与血液发生化学反应,生成沉淀物质而止血 | |
| C. | FeCl3水解生成Fe(OH)3沉淀而沉积于划破处止血 | |
| D. | FeCl3是电解质,使血液中的蛋白质很快疑结而止血 |
| A. | 根据元素组成知道它是化合物 | |
| B. | 因为含有钠离子与氯离子和氧离子,所以该物质是盐 | |
| C. | 该物质可以称为钠盐也可以称为次氯酸盐 | |
| D. | 该物质有强氧化性,生活中可用作消毒剂和漂白剂 |
| A. | 实验室制备CO2的反应为:CaCO3+2HCl═CaCl2+H2O+CO2 | |
| B. | 向氯化铜溶液中滴加硝酸银溶液:Ag++Cl-═AgCl | |
| C. | 氢氧化钡和稀硫酸反应的离子方程式:Ba2++OH-+H++SO42-═BaSO4+H2O | |
| D. | 稀硫酸滴到铜片上:Cu+2H+═Cu2++H2 |
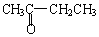
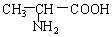 与
与
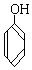 与
与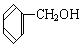
 与
与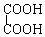
 .
.