题目内容
11.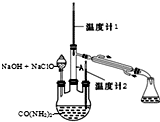 水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:
水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl
N2H4•H2O+2NaClO═N2↑+3H2O+2NaCl
请回答下列问题:
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有BD(填标号).
A.容量瓶B.烧杯C.烧瓶D.玻璃棒
(2)将Cl2通入30%NaOH溶液制备NaClO的化学方程式Cl2+2NaOH=NaClO+NaCl+H2O.
(3)实验时,如果将 NaOH 和NaClO的混合溶液一次性加入三颈烧瓶,可能会造成的结果是反应生成的水合肼会被次氯酸钠氧化.
(4)实验时可根据温度计1温度为118.5℃判断N2H4•H2O开始蒸出.
已知:N2H4•H2O+2I2═N2↑+4HI+H2O.测定水合肼的质量分数可采用下列步骤:
①取1.250g试样,经溶解、转移、定容等步骤,配制250mL溶液.
②移取10.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,加20mL水,摇匀.
③将0.1000mol•L-1碘的标准溶液盛放在酸式滴定管中(填“酸式”或“碱式”),当当锥形瓶中溶液由无色变蓝色,且半分钟不褪色停止滴定,消耗碘的标准溶液为18.00mL,则产品中N2H4•H2O的质量分数为90%.
分析 (1)用天平称量氢氧化钠质量,用量筒量取水的体积,在烧杯中溶解,并用玻璃棒搅拌;
(2)氯气通入到盛有NaOH的锥形瓶中发生反应生成氯化钠、次氯酸钠和水;
(3)由N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl,可知水合肼(N2H4•H2O)具有还原性,易被次氯酸钠氧化;
(4)生成水合肼 (N2H4•H2O) 进行蒸馏分离,温度计1控制馏分水合肼蒸汽温度;
碘水具有强氧化性,能腐蚀碱式滴定管的橡胶;
N2H4•H2O完全反应,加入最后一滴碘溶液,溶液由无色变蓝色且半分钟内不消失,说明滴定到达终点;
由N2H4+2I2=N2+4HI可知水合肼的物质的量,进而计算其质量分数.
解答 解:(1)用天平称量氢氧化钠质量,用量筒量取水的体积,在烧杯中溶解,并用玻璃棒搅拌,所需玻璃仪器除量筒外,还有烧杯、玻璃棒,
故答案为:BD;
(2)氯气通入到盛有NaOH的锥形瓶中发生反应生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH=NaClO+NaCl+H2O;
故答案为:Cl2+2NaOH=NaClO+NaCl+H2O;
(3)由N2H4•H2O+2NaClO=N2↑+3H2O+2NaCl,可知水合肼(N2H4•H2O)具有还原性,如果将 NaOH 和 NaClO 的混合溶液一次性加入三颈烧瓶,反应生成的水合肼会被次氯酸钠氧化,
故答案为:反应生成的水合肼会被次氯酸钠氧化;
(4)生成水合肼 (N2H4•H2O) 进行蒸馏分离,温度计1温度为118.5℃,判断 N2H4•H2O 开始蒸出,
碘单质具有氧化性,能腐蚀碱式滴定管的橡胶,则碘水应装在酸式滴定管中;
加入最后一滴碘溶液,溶液由无色变蓝色且半分钟内不消失,说明滴定到达终点;
由N2H4+2I2=N2+4HI,可知250ml溶液中含有的物质的量=0.100mol/L×0.018L×$\frac{1}{2}$×$\frac{250ml}{10ml}$=0.0225mol,
水合肼(N2H4•H2O)的质量分数=$\frac{0.0225g×50g/mol}{1.250g}$×100%=90%,
故答案为:温度计1温度为118.5℃;酸式;当锥形瓶中溶液由无色变蓝色,且半分钟不褪色;90%.
点评 本题考查物质制备实验,涉及溶液配制、物质含量测定、对操作的分析评价、滴定应用等,注意根据题目信息确定溶液添加顺序,较好的考查学生对实验原理的理解、知识迁移应用,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案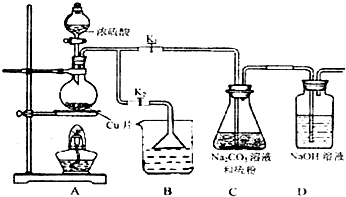
(1)某研究小组设计了制备Na2S203•5H20装置和部分操作步骤如下.
I.打开K1关闭K2,向圆底 烧瓶中加入足量浓硫酸加热.
II.C中混合液被气流搅动,反应一段时间后,硫粉逐渐减少,当C中溶液的pH 接近7时,打开K2,关闭K1即停止C中的反应,停止加热.
III.过滤C中的混合液.
IV.将滤液经过蒸发浓缩、冷却结晶、过滤、洗涤、烘干,得到产品Na2S203.5H20.
回答下列问题:
①II中,“当C中溶液的pH接近7时即停止C中的反应”的原因S2O32-+2H+═S↓+SO2↑+H2O(用离子方程式表示).
②IV中,操作步骤是蒸发浓缩、冷却结晶.
③装置B中盛放的试剂是(填化学式)NaOH溶液.
(2)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO${\;}_{4}^{2-}$全部转化为Cr2O${\;}_{7}^{2-}$;再加过KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.0010mol.L-1 的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如表所示:
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
①Cr2O${\;}_{7}^{2-}$+6I-+14H+═2Cr3++3I2+7H2O;
②I2+2S2O${\;}_{3}^{2-}$═2I-+S4O${\;}_{6}^{2-}$.
Ⅰ.判断达到滴定终点的现象是加入最后一滴Na2S2O3标准溶液后,蓝色消失,且半分钟内颜色不改变
Ⅱ.从表格所给数据计算:一份待测溶液消耗Na2S2O3溶液的平均体积为18.00 ml
Ⅲ.废水中Ba2+的物质的量浓度2.4×10-4mol•L-1.
 2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | △H=E2-E1 | |
| B. | 反应物断键吸收的总能量小于生成物成键释放的总能量 | |
| C. | 升高温度,不影响活化分子百分数 | |
| D. | 使用催化剂使该反应的反应热发生改变 |
| A. | 溶解搅拌时有液体飞溅 | |
| B. | 取KMnO4样品时不慎在表面沾了点蒸馏水 | |
| C. | 定容时俯视容量瓶刻度线 | |
| D. | 定容摇匀后见液面下降,再加水至刻度线 |
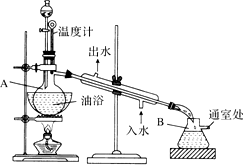 乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,实验室某次制取它用冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是:①先向A蒸馏烧瓶中注入少量乙醇和所用的浓H2SO4后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗待用,这时分液漏斗里乙醇与冰醋酸的物质的量之比约为7:5;②加热油浴,保持温度在135℃~145℃之间;③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加料速度使蒸出酯的速度与进料速度大体相等,直到加料完成;④保持油浴温度一段时间,至不再有液体馏出后,停止加热;⑤取下B吸滤瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边摇荡,直到无气泡产生为止;⑥将⑤的液体混合物分液,弃去水层;⑦将饱和CaCl2溶液(适量)加入到分液漏斗中,摇荡一段时间静置,放出水层(废液);⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品;⑨然后再向其中加入无水硫酸钠,振荡.
乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,实验室某次制取它用冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是:①先向A蒸馏烧瓶中注入少量乙醇和所用的浓H2SO4后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗待用,这时分液漏斗里乙醇与冰醋酸的物质的量之比约为7:5;②加热油浴,保持温度在135℃~145℃之间;③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加料速度使蒸出酯的速度与进料速度大体相等,直到加料完成;④保持油浴温度一段时间,至不再有液体馏出后,停止加热;⑤取下B吸滤瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边摇荡,直到无气泡产生为止;⑥将⑤的液体混合物分液,弃去水层;⑦将饱和CaCl2溶液(适量)加入到分液漏斗中,摇荡一段时间静置,放出水层(废液);⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品;⑨然后再向其中加入无水硫酸钠,振荡.
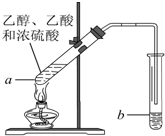 在实验室可以在试管a中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL 乙酸,按下图所示,连接好装置进行实验,以制取乙酸乙酯.回答下列问题:
在实验室可以在试管a中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL 乙酸,按下图所示,连接好装置进行实验,以制取乙酸乙酯.回答下列问题: