题目内容
1.为配制0.01mol•L-1 的KMnO4 消毒液,下列操作导致所配溶液浓度偏高的是( )| A. | 溶解搅拌时有液体飞溅 | |
| B. | 取KMnO4样品时不慎在表面沾了点蒸馏水 | |
| C. | 定容时俯视容量瓶刻度线 | |
| D. | 定容摇匀后见液面下降,再加水至刻度线 |
分析 配制0.01mol•L-1 的KMnO4 消毒液,结合c=$\frac{n}{V}$及不当操作对n、V的影响判断所配溶液浓度,以此来解答.
解答 解:A.溶解搅拌时有液体飞溅,n偏小,由c=$\frac{n}{V}$可知,所配溶液浓度偏低,故A不选;
B.取KMnO4样品时不慎在表面沾了点蒸馏水,称量固体的质量偏小,n偏小,由c=$\frac{n}{V}$可知,所配溶液浓度偏低,故B不选;
C.定容时俯视容量瓶刻度线,溶液体积V偏小,由c=$\frac{n}{V}$可知,所配溶液浓度偏高,故C选;
D.定容摇匀后见液面下降,再加水至刻度线,溶液体积V偏大,由c=$\frac{n}{V}$可知,所配溶液浓度偏低,故D不选;
故选C.
点评 本题考查配制一定浓度的溶液,为高频考点,把握溶液配制的操作、物质的量和体积的变化为解答的关键,侧重分析与实验能力的考查,注意溶液配制的误差分析,题目难度不大.

练习册系列答案
相关题目
9.通过用水溶解、过滤、蒸发等操作,可将下列各组混合物分离的是( )
| A. | 硝酸钾、氢氧化钠 | B. | 氧化铜、二氧化锰 | C. | 氯化钾、二氧化锰 | D. | 硫酸铜、氢氧化钡 |
16.七铝十二钙 (12CaO•7Al2O3)是一种新型的超导材料和发光材料,它是用AlC13溶液溶解一定量的CaCO3形成溶液,再用氨水沉淀,然后锻烧沉淀制备.工业上制备AlC13溶液用图示流程(已知A1C13易升华).
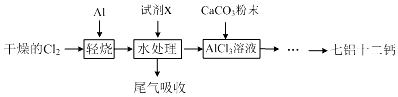
(1)轻烧后的气体用水处理前导气管为何要保温?为了防止AlC13蒸气凝华堵塞导气管
(2)用水处理添加的试剂X是盐酸,其目的是抑制铝离子水解.
(3)AlC13溶液溶解CaCO3时,要控制碳酸钙和AlC13的量,要求n(CaCO3):n(A1C13)>12:14,其原因是氢氧化钙微溶于水,造成损失.用氨水沉淀、过滤后的滤液主要成分是NH4Cl(少量CaCl2).
(4)以工业碳酸钙(含有少量A12O3、Fe3O4杂质)生产二水合氯化钙(CaC12•2H2O)的方法为:将工业碳酸钙溶于盐酸,加入双氧水,加入氢氧化钙,搅拌,用pH计调节溶液的pH为4.7,过滤.(实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计).
已知:几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
补全实验步骤:向滤液中加盐酸酸化,蒸发浓缩,冷却结晶,过滤冰水洗涤,干燥,得到CaC12•2H2O.

(1)轻烧后的气体用水处理前导气管为何要保温?为了防止AlC13蒸气凝华堵塞导气管
(2)用水处理添加的试剂X是盐酸,其目的是抑制铝离子水解.
(3)AlC13溶液溶解CaCO3时,要控制碳酸钙和AlC13的量,要求n(CaCO3):n(A1C13)>12:14,其原因是氢氧化钙微溶于水,造成损失.用氨水沉淀、过滤后的滤液主要成分是NH4Cl(少量CaCl2).
(4)以工业碳酸钙(含有少量A12O3、Fe3O4杂质)生产二水合氯化钙(CaC12•2H2O)的方法为:将工业碳酸钙溶于盐酸,加入双氧水,加入氢氧化钙,搅拌,用pH计调节溶液的pH为4.7,过滤.(实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计).
已知:几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.5 | 4.7 |
13.下列反应中,因反应物浓度改变,反应产物也会改变的是( )
| A. | N2和O2的反应 | B. | Na和O2的反应 | C. | Fe和Cl2的反应 | D. | 铜和硝酸的反应 |
10.下列叙述与胶体的性质无关的是( )
| A. | 江河入海口容易形成三角洲 | |
| B. | 当日光从窗隙射入暗室时,可观察到一束光线 | |
| C. | 向氢氧化铁与水形成的某分散系中插入正、负电极,通直流电一段时间后,一极附近颜色变深 | |
| D. | 向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀 |
11.下列反应的离子方程式,书写错误的是( )
| A. | 氢氧化铁与盐酸反应OH-+H+═H2O | |
| B. | 用稀硫酸清除铁锈Fe2O3+6H+═2Fe3++3H2O | |
| C. | 食盐水中滴加硝酸银溶液Cl-+Ag+═AgCl↓ | |
| D. | 氢氧化钡跟硫酸铜溶液的反应Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ |
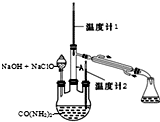 水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:
水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应: .
.