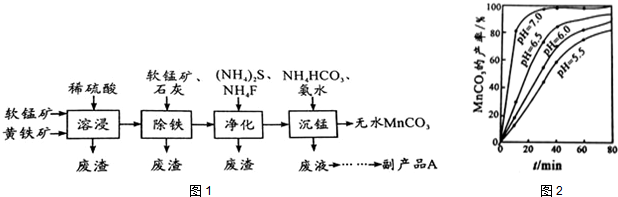
题目内容
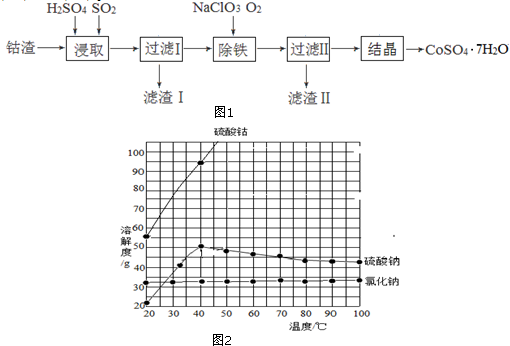
6.近日,一家中国企业并购了刚果(金)大型铜钴矿.据媒体分析,中国是钴消费大国,但钴资源贫乏,为获取钴资源是此次收购的重要原因.钴是制造锂电池不可或缺的原料,硫酸钴晶体可用于制造碱性电池、生产含钴颜料和其它钴产品.利用钴渣[含Co(OH)3、Fe(OH)3]制备硫酸钴晶体(CoSO4•7H2O)的工艺流程如图1: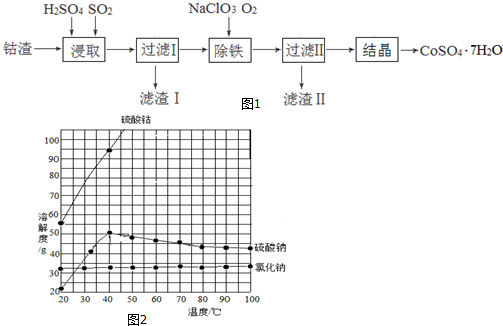
已知:有关物质的溶解度随温度变化关系如图2:
(1)均速向钴渣和稀硫酸的化合物中通入SO2,使Co(OH)3、Fe(OH)3被充分浸取,其中浸取Co(OH)3的离子方程式为2Co(OH)3+2H++SO2=2 Co2++SO42-+4H2O;
(2)除铁过程中,若选用氧化性更强的NaClO除铁,可能造成的后果是氧化性过强会使Co2+被氧化.
(3)滤渣Ⅱ的成分为Fe(OH)3;
(4)过滤Ⅱ得到的滤液经过蒸发浓缩、趁热过滤、冷却到40℃结晶操作得到CoSO4•7H2O粗产品.冷却到40℃结晶的原因是防止析出硫酸钠晶体.
分析 钴渣在稀硫酸溶液中酸浸且通入二氧化硫气体,酸性条件下Co(OH)3、Fe(OH)3被二氧化硫还原生成Co2+、Fe2+,过滤得到滤液I中含有Co2+、Fe2+,向滤液中加入氯酸钠且同时通入氧气,Co2+、Fe2+被氧化,调节溶液的pH值将铁离子转化为Fe(OH)3而除去,所以滤渣II为Fe(OH)3,氯酸钠被还原生成NaCl,根据溶解度曲线知,硫酸钴随着温度升高而增大,硫酸钠溶解度随着温度升高先升高后降低,氯化钠溶解度随着温度升高而变化不大,将滤液蒸发浓缩、趁热过滤、冷却到40℃结晶操作得到CoSO4•7H2O粗产品,结合题目分析解答.
解答 解:钴渣在稀硫酸溶液中酸浸且通入二氧化硫气体,酸性条件下Co(OH)3、Fe(OH)3被二氧化硫还原生成Co2+、Fe2+,过滤得到滤液I中含有Co2+、Fe2+,向滤液中加入氯酸钠且同时通入氧气,Co2+、Fe2+被氧化,调节溶液的pH值将铁离子转化为Fe(OH)3而除去,所以滤渣II为Fe(OH)3,氯酸钠被还原生成NaCl,根据溶解度曲线知,硫酸钴随着温度升高而增大,硫酸钠溶解度随着温度升高先升高后降低,氯化钠溶解度随着温度升高而变化不大,将滤液蒸发浓缩、趁热过滤、冷却到40℃结晶操作得到CoSO4•7H2O粗产品,
(1)酸性条件下,氢氧化钴被二氧化硫还原生成二价钴离子,同时生成硫酸根离子和水,离子方程式为2Co(OH)3+2H++SO2=2 Co2++SO42-+4H2O,
故答案为:2Co(OH)3+2H++SO2=2 Co2++SO42-+4H2O;
(2)除铁过程中,若选用氧化性更强的NaClO除铁,次氯酸钠具有强氧化性,能氧化钴离子而导致得不到CoSO4•7H2O,所以不能选取NaClO作氧化剂,
故答案为:氧化性过强会使Co2+被氧化;
(3)通过以上分析知,滤渣II为Fe(OH)3,
故答案为:Fe(OH)3;
(4)过滤后得到的滤液II中含有硫酸钴、硫酸钠、氯化钠,且硫酸钴溶解度随着温度升高而增大,20-40℃硫酸钠溶解度随着温度升高而增大,40℃后硫酸钠溶解度随着温度升高而降低,氯化钠溶解度随着温度升高变化不大,所以要从溶液中得到硫酸钴晶体,应该采用蒸发浓缩、趁热过滤,冷却到40℃结晶操作得到CoSO4•7H2O粗产品,防止硫酸钴析出而降低产率,冷却到40℃结晶,因为该温度下硫酸钴溶解度降低较大,硫酸钠溶解度较小,防止析出硫酸钠晶体,
故答案为:蒸发浓缩、趁热过滤;防止析出硫酸钠晶体.
点评 本题考查物质制备,为高考常考查方式,明确流程图中发生的反应、物质分离提纯方法及物质性质是解本题关键,侧重考查学生分析判断、识图及理解应用能力,易错点是(4)题分析,题目难度中等.

| 编号 | A的初始浓 度/(mol•L-1) | B的初始浓 度/(mol•L-1) | 生成C的初始速 率/(mol•L-1•s-1) |
| 1 | 1.0 | 1.0 | 1.2×10-2 |
| 2 | 2.0 | 1.0 | 2.4×10-2 |
| 3 | 1.0 | 2.0 | 4.8×10-2 |
(2)当c(A)=c(B)=2.0mol•L-1时,以B表示的初始反应速率为0.144mol•L-1•s-1.
 香蕉水主要用作喷漆的溶剂和稀释剂,其主要成分乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味.实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
香蕉水主要用作喷漆的溶剂和稀释剂,其主要成分乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味.实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
| 物质名称 | 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
实验步骤:
在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A(加热和夹持装置略),回流50min.反应液冷至室温后倒入分液漏斗中,先用少量水、饱和碳酸氢钠溶液洗,再用水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1)若在实验过程中发现忘记加入碎片,则应采取的措施是停止加热,待反应液冷却后加入碎瓷片.
(2)在洗涤操作中第二次用水洗的主要目的是洗掉碳酸氢钠.
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后粗产品应从分液漏斗的上(填“上”或“下”)口分离出.
(4)实验中加入少量无水MgSO4的目的是干燥.
(5)本实验的产率是c(填标号).
a.30% b.40% c.60% d.90%
(6)在进行蒸馏操作时,发现实验的产率偏高,其可能原因是未到140℃就收集馏分(会收集少量未反应的异戊醇).
 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、纺织等工业.乙酸乙酯的实验室和工业制法如下:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、纺织等工业.乙酸乙酯的实验室和工业制法如下:CH3COOH+C2H5OH$\frac{\underline{\;浓硫酸\;}}{△}$CH3COOC2H5+H2O
回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有(答出2点即可):增大乙醇浓度、移去生成物等.
(2)若用如图所示装置制备乙酸乙酯,产率往往偏低.其原因是(答出2点即可):原料来不及反应就被蒸出,或温度过高发生副反应;
(3)此反应以浓硫酸为催化剂,可能会造成(答出2点即可)产生大量酸性废液污染环境,或部分原料炭化等问题.
(4)目前对催化剂进行研究,发现质子酸(能提供H+)离子液体可用作此反应的催化剂,且能重复使用.实验数据如下(乙酸和乙醇等物质的量):
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度 | 转化率(%) | 选择性(%) | 反应时间 | 转化率(%) | 选择性(%) |
| 40℃ | 77.8 | 100 | 2h | 80.2 | 100 |
| 60℃ | 92.3 | 100 | 3h | 87.8 | 100 |
| 80℃ | 92.6 | 100 | 4h | 92.3 | 100 |
| 120℃ | 94.5 | 98.7 | 6h | 93 | 100 |
| 注:选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
②当反应达到120℃时,反应选择性降低的原因可能是:乙醇脱水生成乙醚.
| A. | 2CO (g )+O2(g )═2CO2(g );△H=-556kJ•mol-1 | |
| B. | CH4(g )+2O2 (g )═CO2(g )+2H2O (l );△H=-890kJ•mol-1 | |
| C. | 2H2(g )+O2(g )═2H2O(l );△H=-571.6kJ•mol-1 | |
| D. | 2H2(g )+2 Cl2 (g )═4HCl (g);△H=-369.2kJ•mol-1 |
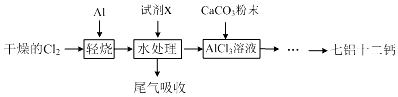
(1)轻烧后的气体用水处理前导气管为何要保温?为了防止AlC13蒸气凝华堵塞导气管
(2)用水处理添加的试剂X是盐酸,其目的是抑制铝离子水解.
(3)AlC13溶液溶解CaCO3时,要控制碳酸钙和AlC13的量,要求n(CaCO3):n(A1C13)>12:14,其原因是氢氧化钙微溶于水,造成损失.用氨水沉淀、过滤后的滤液主要成分是NH4Cl(少量CaCl2).
(4)以工业碳酸钙(含有少量A12O3、Fe3O4杂质)生产二水合氯化钙(CaC12•2H2O)的方法为:将工业碳酸钙溶于盐酸,加入双氧水,加入氢氧化钙,搅拌,用pH计调节溶液的pH为4.7,过滤.(实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计).
已知:几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.5 | 4.7 |
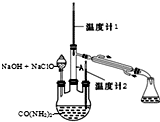 水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:
水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应: