题目内容
3.氯酸(HClO3)具有强酸性及强氧化性,可用于制取多种氯酸盐.Ba(ClO3)2、AgClO3可溶于水.40%的氯酸溶液加热时会分解,产物可能有O2和Cl2.回答下列问题:(1)实验室可用氯酸钡和稀硫酸反应制备氯酸,反应原理为Ba(ClO3)2+H2SO4═BaSO4↓+2HClO3.
①仪器a的名称是分液漏斗.
②将氯酸分离出来的操作方法是过滤.

(2)某科研小组按照如图2所示的装置,通过实验检验氯酸的分解产物.
①装置A中可观察到的现象是产生黄绿色气体,由此可知氯酸分解的产物中有Cl2.
②装置B的主要作用是吸收氯气,装置C的作用是干燥气体.
③检验另一气体产物的操作是将带火星的木条放置在C的出气口,现象是木条复燃.
(3)浓度较高的氯酸与铜反应会生成ClO2气体,请写出该反应的离子方程式:Cu+2ClO3-+4H+=Cu2++2ClO2↑+2H2O.
(4)氯酸钠在常温下为白色粉末,味咸,约300℃时释放出氧气,较高温度全部分解.请设计实验进行鉴别NaCl与氯酸钠(至少写两种,不包括本题中已使用的性质):
①将两种固体物质加热到300℃以上,若有气体产生,证明待鉴物质为NaClO3.
②在两种待鉴物质的溶液中分别加入AgNO3溶液,若有白色沉淀产生,证明待鉴物质为NaCl.
分析 (1)①由图可知仪器的名称;
②由Ba(ClO3)2+H2SO4═BaSO4↓+2HClO3可知,硫酸钡不溶于水;
(2)①氯酸受热分解生成O2和Cl2,Cl2为黄绿色气体,根据A中气体颜色判断生成含有氯气;
②氯气能和水反应生成HCl、HClO,所以氯气能和碱溶液反应;浓硫酸具有吸水性,能干燥气体;
③氧气具有助燃性,可以用带火星的木条检验;
(3)浓度较高的氯酸与铜反应会生成ClO2气体,Cu被氧化生成Cu 2+,该反应中Cl元素化合价由+5价变为+4价、Cu元素化合价由0价变为+2价,根据转移电子守恒配平方程式;
(4)由信息可知,氯酸钠加热分解,且与硝酸银不反应,而NaCl不分解,与硝酸银反应生成白色沉淀.
解答 解:(1)①仪器a的名称是分液漏斗,故答案为:分液漏斗;
②由Ba(ClO3)2+H2SO4═BaSO4↓+2HClO3可知,硫酸钡不溶于水,则将氯酸分离出来的操作方法是过滤,故答案为:过滤;
(2)①氯酸受热分解生成O2和Cl2,Cl2为黄绿色气体,如果A中气体呈黄绿色,所以看到的现象是A中气体呈黄绿色,由此可知氯酸分解的产物中含有Cl2,
故答案为:产生黄绿色气体;Cl2;
②氯气能和水反应生成HCl、HClO,所以氯气能和碱溶液反应,则B的作用是吸收氯气;浓硫酸具有吸水性,能干燥气体,所以C的作用是干燥气体,
故答案为:吸收氯气;干燥气体;
③氧气具有助燃性,可以用带火星的木条检验,所以检验另一种气体的方法是:将带火星的木条放置在C的出气口,如果带火星的木条复燃就证明有氧气生成,
故答案为:将带火星的木条放置在C的出气口;木条复燃;
(3)浓度较高的氯酸与铜反应会生成ClO2气体,Cu被氧化生成Cu 2+,该反应中Cl元素化合价由+5价变为+4价、Cu元素化合价由0价变为+2价,转移电子数为2,根据转移电子守恒配平方程式为Cu+2ClO3-+4H+=Cu2++2ClO2↑+2H2O,
故答案为:Cu+2ClO3-+4H+=Cu2++2ClO2↑+2H2O;
(4)由信息可知,氯酸钠加热分解,且与硝酸银不反应,而NaCl不分解,与硝酸银反应生成白色沉淀,则鉴别二者的方法为①将两种固体物质加热到300℃以上,若有气体产生,证明待鉴物质为NaClO3;②在两种待鉴物质的溶液中分别加入AgNO3溶液,若有白色沉淀产生,证明待鉴物质为NaCl,
故答案为:将两种固体物质加热到300℃以上,若有气体产生,证明待鉴物质为NaClO3;在两种待鉴物质的溶液中分别加入AgNO3溶液,若有白色沉淀产生,证明待鉴物质为NaCl.
点评 本题考查物质的制备实验,为高频考点,把握制备实验原理、物质的性质、物质的鉴别和检验等为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的综合应用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案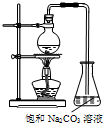 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、纺织等工业.乙酸乙酯的实验室和工业制法如下:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、纺织等工业.乙酸乙酯的实验室和工业制法如下:CH3COOH+C2H5OH$\frac{\underline{\;浓硫酸\;}}{△}$CH3COOC2H5+H2O
回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有(答出2点即可):增大乙醇浓度、移去生成物等.
(2)若用如图所示装置制备乙酸乙酯,产率往往偏低.其原因是(答出2点即可):原料来不及反应就被蒸出,或温度过高发生副反应;
(3)此反应以浓硫酸为催化剂,可能会造成(答出2点即可)产生大量酸性废液污染环境,或部分原料炭化等问题.
(4)目前对催化剂进行研究,发现质子酸(能提供H+)离子液体可用作此反应的催化剂,且能重复使用.实验数据如下(乙酸和乙醇等物质的量):
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度 | 转化率(%) | 选择性(%) | 反应时间 | 转化率(%) | 选择性(%) |
| 40℃ | 77.8 | 100 | 2h | 80.2 | 100 |
| 60℃ | 92.3 | 100 | 3h | 87.8 | 100 |
| 80℃ | 92.6 | 100 | 4h | 92.3 | 100 |
| 120℃ | 94.5 | 98.7 | 6h | 93 | 100 |
| 注:选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
②当反应达到120℃时,反应选择性降低的原因可能是:乙醇脱水生成乙醚.
 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ.根据以上信息和数据,下列说法正确的是( )
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ.根据以上信息和数据,下列说法正确的是( )| A. | N4与N2互为同分异构体 | |
| B. | 1mo1N4气体转变为N2将吸收882kJ热量 | |
| C. | N4(g)=2N2(g)△H=-882KJ | |
| D. | P4(白磷)的分子结构与N4相似,1mol N4和1mol P4均含有6mol非极性键 |
| A. | 2CO (g )+O2(g )═2CO2(g );△H=-556kJ•mol-1 | |
| B. | CH4(g )+2O2 (g )═CO2(g )+2H2O (l );△H=-890kJ•mol-1 | |
| C. | 2H2(g )+O2(g )═2H2O(l );△H=-571.6kJ•mol-1 | |
| D. | 2H2(g )+2 Cl2 (g )═4HCl (g);△H=-369.2kJ•mol-1 |
| A. | N2和O2的反应 | B. | Na和O2的反应 | C. | Fe和Cl2的反应 | D. | 铜和硝酸的反应 |
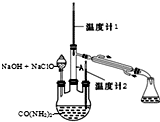 水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:
水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应: