题目内容
某课外兴趣小组对H202的分解速率做了如下实验探究.
(1)下表是该小组研究影响过氧化氢(H202)分解速率的因素时采集的一组数据:
[用10mlH202制取150ml 02所需的时间(秒)]
从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?
(2)将质量相同但聚集状态不同的MnO2分别加入5mL 5%的双氧水中,并用带火星的木条测试.
测定结果如下表:
实验结果说明催化剂作用的大小与 有关.
(3)有A、B两位学生均想利用原电池反应验证金属的活动性顺序,并探究产物的有关性质.分别设计了如图所示的原电池,请完成下列问题:
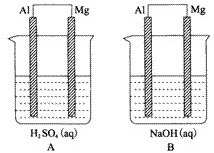
(a)①负极材料:A池 ,B池 .②电极反应式:A池:正极: ,负极: .
(b)B池总反应的离子方程式为 .
(1)下表是该小组研究影响过氧化氢(H202)分解速率的因素时采集的一组数据:
[用10mlH202制取150ml 02所需的时间(秒)]
| 浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
(2)将质量相同但聚集状态不同的MnO2分别加入5mL 5%的双氧水中,并用带火星的木条测试.
测定结果如下表:
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
(3)有A、B两位学生均想利用原电池反应验证金属的活动性顺序,并探究产物的有关性质.分别设计了如图所示的原电池,请完成下列问题:

(a)①负极材料:A池
(b)B池总反应的离子方程式为
考点:探究影响化学反应速率的因素
专题:化学反应速率专题
分析:(1)掌握催化剂的特点“一变二不变”和催化作用(改变反应速率),了解影响化学反应速率的因素:温度、催化剂、反应物本身的性质,状态等;
(2)由实验现象可知,催化剂作用大小的影响因素;
(3)(a)在原电池中,失电子的极是负极,发生氧化反应,得电子的极是正极,发生还原反应,据此回答;
(b)原电池中的总反应是自发的氧化还原反应.
(2)由实验现象可知,催化剂作用大小的影响因素;
(3)(a)在原电池中,失电子的极是负极,发生氧化反应,得电子的极是正极,发生还原反应,据此回答;
(b)原电池中的总反应是自发的氧化还原反应.
解答:
解:(1)分析表中数据可以看出,浓度越大,反应速率越快,加热能加快过氧化氢的分解,有催化剂是分解速率快,故答案为:浓度越高,过氧化氢的分解速率越快(或温度越高,过氧化氢的分解速率越快;使用催化剂,过氧化氢的分解速率越快);
(2)因在其他条件相同时,粉末状二氧化锰比块状二氧化锰反应所需时间短,说明接触面积对反应速率有影响,故答案为:催化剂的聚集状态或是表面积;
(3)(a)金属铝、镁硫酸构成的原电池,金属镁是负极,电极反应:Mg-2e-=Mg2+,金属铝是正极,电极反应:2H++2e-=H2↑; 自发的氧化还原反应是金属镁和硫酸之间的反应,金属铝、镁、氢氧化钠构成的原电池,金属铝是负极,Al-3e-=Al3+;金属镁是正极,自发的氧化还原反应是金属铝和氢氧化钠之间的反应,
故答案为:Mg;Al;2H++2e-=H2↑;Al-3e-=Al3+;
(b)金属铝、镁、氢氧化钠构成的原电池,自发的氧化还原反应是金属铝和氢氧化钠之间的反应,反应的实质是:2Al+2H2O+2OH-=2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑.
(2)因在其他条件相同时,粉末状二氧化锰比块状二氧化锰反应所需时间短,说明接触面积对反应速率有影响,故答案为:催化剂的聚集状态或是表面积;
(3)(a)金属铝、镁硫酸构成的原电池,金属镁是负极,电极反应:Mg-2e-=Mg2+,金属铝是正极,电极反应:2H++2e-=H2↑; 自发的氧化还原反应是金属镁和硫酸之间的反应,金属铝、镁、氢氧化钠构成的原电池,金属铝是负极,Al-3e-=Al3+;金属镁是正极,自发的氧化还原反应是金属铝和氢氧化钠之间的反应,
故答案为:Mg;Al;2H++2e-=H2↑;Al-3e-=Al3+;
(b)金属铝、镁、氢氧化钠构成的原电池,自发的氧化还原反应是金属铝和氢氧化钠之间的反应,反应的实质是:2Al+2H2O+2OH-=2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑.
点评:本题考查学生影响化学反应速率的因素以及原电池的工作原理等知识,属于综合知识的考查,注意知识的归纳和整理是解题关键,难度中等.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
今有pH相同的硫酸和醋酸各100mL,将足量的镁条分别加入到硫酸溶液和醋酸溶液中,关于反应的叙述正确的是( )
| A、因为硫酸是强电解质,在水溶液中完全电离,所以刚开始其反应速率更快 |
| B、整个反应过程中两者的反应速率相同 |
| C、镁与硫酸反应产生的氢气比醋酸与镁反应产生的氢气少 |
| D、硫酸的物质的量浓度大于醋酸 |
下列化合物中,含有非极性键的离子化合物是( )
①Ba(OH)2 ②H2SO4 ③Na2O2 ④CaCl2.
①Ba(OH)2 ②H2SO4 ③Na2O2 ④CaCl2.
| A、③ | B、①③④ |
| C、③④ | D、①②③④ |
