题目内容
按要求写离子方程式
(1)醋酸与氢氧化钠溶液反应;
(2)大理石与稀盐酸反应;
(3)标准状况下11.2升CO2通入250ml 2mol/L的氢氧化钠中;
(4)向氢氧化钡溶液中逐滴加入NaHCO3溶液至恰好沉淀完全.
(1)醋酸与氢氧化钠溶液反应;
(2)大理石与稀盐酸反应;
(3)标准状况下11.2升CO2通入250ml 2mol/L的氢氧化钠中;
(4)向氢氧化钡溶液中逐滴加入NaHCO3溶液至恰好沉淀完全.
考点:离子方程式的书写
专题:离子反应专题
分析:(1)醋酸与氢氧化钠溶液酸碱中和生成醋酸钠和水;
(2)大理石与稀盐酸反应生成氯化钙和水;
(3)二氧化碳的物质的量为
=0.5mol,氢氧化钠的物质的量为:0.25L×2mol/L=0.5L,二者按照1:1反应生成碳酸氢钠;
(4)要使恰好沉淀完全,则氢氧化钡与NaHCO3物质的量之比为1:1,反应生成碳酸钡和氢氧化钠、水.
(2)大理石与稀盐酸反应生成氯化钙和水;
(3)二氧化碳的物质的量为
| 11.2L |
| 22.4L/mol |
(4)要使恰好沉淀完全,则氢氧化钡与NaHCO3物质的量之比为1:1,反应生成碳酸钡和氢氧化钠、水.
解答:
解:(1)醋酸与氢氧化钠反应的离子方程式:CH3COOH+OH-=CH3COO-+H2O,
答:CH3COOH+OH-=CH3COO-+H2O;
(2)大理石与稀盐酸离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,
答:CaCO3+2H+=Ca2++CO2↑+H2O;
(3)二氧化碳与氢氧化钠1:1反应的离子方程式:CO2+OH-=HCO3-,
答:CO2+OH-=HCO3-;
(4)向氢氧化钡溶液中逐滴加入NaHCO3溶液至恰好沉淀完全反应的离子方程式为:Ba2++OH-+HCO3-=BaCO3↓+H2O,
答:Ba2++OH-+HCO3-=BaCO3↓+H2O.
答:CH3COOH+OH-=CH3COO-+H2O;
(2)大理石与稀盐酸离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,
答:CaCO3+2H+=Ca2++CO2↑+H2O;
(3)二氧化碳与氢氧化钠1:1反应的离子方程式:CO2+OH-=HCO3-,
答:CO2+OH-=HCO3-;
(4)向氢氧化钡溶液中逐滴加入NaHCO3溶液至恰好沉淀完全反应的离子方程式为:Ba2++OH-+HCO3-=BaCO3↓+H2O,
答:Ba2++OH-+HCO3-=BaCO3↓+H2O.
点评:本题考查了离子方程式书写,题目难度不大,易错点为(3)(4),有关反应物用量多少的离子方程式的书写,注意少量、适量、过量或逐滴加入等条件来限定某一反应物的量,一般是以量少的作为标准来书写.

练习册系列答案
相关题目
下列说法中,正确的是( )
| A、在标准状况下,11g CO2和 5.6L N2所含分子数相同 |
| B、80g NaOH溶解在1L水中,得到溶液的物质的量浓度为2mol?L-1 |
| C、标准状况下,22.4L水中所含的分子数约为6.02×1023 |
| D、标准状况下,20mL NH3跟60mL N2所含分子个数比为1:3 |
下列说法正确的是( )
| A、经测定某物质只含一种元素,则该物质一定是单质 |
| B、难溶于水的电解质一定是弱电解质 |
| C、离子化合物中可能含有共价键 |
| D、既能与酸又能与碱反应的化合物一定是两性化合物 |
下列物质中,存在共价键的化合物的是( )
| A、NaCl |
| B、MgCl2 |
| C、I2 |
| D、H2O |
下列有关电池的说法不正确的是( )
| A、手机上用的锂离子电池属于二次电池 |
| B、废电池必须进行集中处理其首要原因是防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
| C、氢氧燃料电池可把电能转化为化学能,是一种具有应用前景的绿色能源 |
| D、氢氧燃料电池是一种不需要将还原剂和氧化剂全部储存在电池内的新型发电装置 |
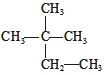 ③白磷 ④氯水 ⑤
③白磷 ④氯水 ⑤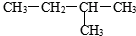 ⑥
⑥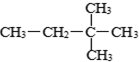 ⑧2,2-二甲基丁烷⑨红磷 ⑩
⑧2,2-二甲基丁烷⑨红磷 ⑩