题目内容
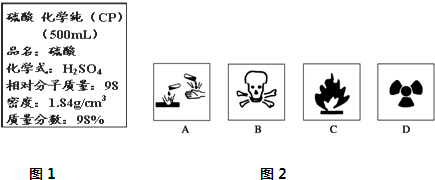
图1是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.
Ⅰ.现欲用该浓硫酸配制成1mol/L的稀硫酸.现实验室仅需要这种稀硫酸220mL.试回答下列问题:
(1)用量筒量取该浓硫酸 mL.
(2)配制时,必须使用的仪器除量筒、烧杯外,还缺少的仪器是 .
(3)若在稀释过程中,浓硫酸不慎沾在手上,处理方法为 .
(4)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是 .
A.用量筒量取浓硫酸时俯视
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中.
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切
E.容量瓶不干燥
F.定容时,俯视容量瓶刻度线
Ⅱ.
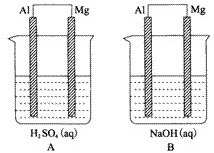
(1)在盛放浓硫酸的试剂瓶的标签上应印有图2警示标志中的 .
(2)若将该浓硫酸与等质量的水混合,则所得溶液中溶质物质的量浓度 9.2mol/L(填>、<、=)
Ⅰ.现欲用该浓硫酸配制成1mol/L的稀硫酸.现实验室仅需要这种稀硫酸220mL.试回答下列问题:
(1)用量筒量取该浓硫酸
(2)配制时,必须使用的仪器除量筒、烧杯外,还缺少的仪器是
(3)若在稀释过程中,浓硫酸不慎沾在手上,处理方法为
(4)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是
A.用量筒量取浓硫酸时俯视
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中
C.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中.
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切
E.容量瓶不干燥
F.定容时,俯视容量瓶刻度线
Ⅱ.
(1)在盛放浓硫酸的试剂瓶的标签上应印有图2警示标志中的
(2)若将该浓硫酸与等质量的水混合,则所得溶液中溶质物质的量浓度

考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:Ⅰ(1)根据c=
计算浓H2SO4的物质的量浓度,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;
(2)根据配制一定物质的量浓度的溶液的配制步骤选择使用的仪器;
(3)根据实验操作对c=
的影响判断各选项对配制的溶液浓度的影响;
Ⅱ(1)浓硫酸具有强烈的腐蚀性;
(2)根据c=
计算,注意硫酸的浓度越大,密度越大,以此判断浓度大小关系.
| 1000ρω |
| M |
(2)根据配制一定物质的量浓度的溶液的配制步骤选择使用的仪器;
(3)根据实验操作对c=
| n |
| V |
Ⅱ(1)浓硫酸具有强烈的腐蚀性;
(2)根据c=
| 1000ρω |
| M |
解答:
解:Ⅰ(1)浓H2SO4的物质的量浓度c=
mol/L=18.4mol/L;
根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,则有:
xmL×18.4mol/L=220mL×1mol/L,解得:x≈12.0;
操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.由提供的仪器可知还需要仪器有250mL容量瓶、胶头滴管、玻璃棒,
故答案为:12.0,250mL容量瓶、胶头滴管、玻璃棒;
(2)若在稀释过程中,浓硫酸不慎沾在手上,处理方法为 先用布擦,再用大量水冲洗、最后涂上3%~5%的NaHCO3溶液,故答案为:先用布擦,再用大量水冲洗、最后涂上3%~5%的NaHCO3溶液;
(3)A.量取浓硫酸时,俯视读数,导致量取的浓硫酸体积偏小,配制的溶液中溶质的物质的量偏小,溶液浓度偏低;
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中,导致配制溶液体积偏小,溶液浓度偏高;
C.洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中,导致配制的溶液中溶质的物质的量偏大,溶液浓度偏高;
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切,导致配制的溶液体积偏大,配制的溶液浓度偏低;
E.容量瓶不干燥,由于定容还需要加入蒸馏水,所以不影响配制结果;
F.定容时,俯视容量瓶刻度线,导致配制溶液体积偏小,溶液浓度偏高;
故答案为:B C F;
II(1)浓硫酸具有强烈的腐蚀性,所以应标签上应印有腐蚀品标志.
故选:A;
(2)根据c=
计算,设98%的浓H2SO4的密度为x,49%的H2SO4溶液的密度为y,物质的量浓度为c,
则:
=18.4,
=c
所以:
=
,因硫酸的浓度越大,密度越大,则x>y,
则:c<9.2mol/L,
故答案为:<.
| 1000×1.84×98% |
| 98 |
根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,则有:
xmL×18.4mol/L=220mL×1mol/L,解得:x≈12.0;
操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.由提供的仪器可知还需要仪器有250mL容量瓶、胶头滴管、玻璃棒,
故答案为:12.0,250mL容量瓶、胶头滴管、玻璃棒;
(2)若在稀释过程中,浓硫酸不慎沾在手上,处理方法为 先用布擦,再用大量水冲洗、最后涂上3%~5%的NaHCO3溶液,故答案为:先用布擦,再用大量水冲洗、最后涂上3%~5%的NaHCO3溶液;
(3)A.量取浓硫酸时,俯视读数,导致量取的浓硫酸体积偏小,配制的溶液中溶质的物质的量偏小,溶液浓度偏低;
B.稀释浓硫酸时,未冷却到室温即转移到容量瓶中,导致配制溶液体积偏小,溶液浓度偏高;
C.洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中,导致配制的溶液中溶质的物质的量偏大,溶液浓度偏高;
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切,导致配制的溶液体积偏大,配制的溶液浓度偏低;
E.容量瓶不干燥,由于定容还需要加入蒸馏水,所以不影响配制结果;
F.定容时,俯视容量瓶刻度线,导致配制溶液体积偏小,溶液浓度偏高;
故答案为:B C F;
II(1)浓硫酸具有强烈的腐蚀性,所以应标签上应印有腐蚀品标志.
故选:A;
(2)根据c=
| 1000ρω |
| M |
则:
| 1000x×98% |
| 98 |
| 1000y×49% |
| 98 |
所以:
| 2x |
| y |
| 18.4 |
| c |
则:c<9.2mol/L,
故答案为:<.
点评:本题考查了配制一定物质的量浓度的溶液方法及误差分析,题目难度不大,注意掌握配制一定物质的量浓度的溶液的配制步骤及误差分析方法,试题有利于培养学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
完全燃烧等物质的量的下列有机物,耗氧量最少的是( )
| A、CH2=CH2 |
| B、CH3CH2OH |
| C、CH3CHO |
D、 |
下列有关电池的说法不正确的是( )
| A、手机上用的锂离子电池属于二次电池 |
| B、废电池必须进行集中处理其首要原因是防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
| C、氢氧燃料电池可把电能转化为化学能,是一种具有应用前景的绿色能源 |
| D、氢氧燃料电池是一种不需要将还原剂和氧化剂全部储存在电池内的新型发电装置 |
 ③白磷 ④氯水 ⑤
③白磷 ④氯水 ⑤ ⑥
⑥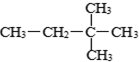 ⑧2,2-二甲基丁烷⑨红磷 ⑩
⑧2,2-二甲基丁烷⑨红磷 ⑩ 如图所示,水槽中试管内有一枚铁钉,放置数天观察:
如图所示,水槽中试管内有一枚铁钉,放置数天观察: 某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在三种不同条件下进行,其中NO、O2的起始浓度都为0mol?L-1,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.
某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在三种不同条件下进行,其中NO、O2的起始浓度都为0mol?L-1,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.