题目内容
14.将充有n mL NO和m mL NO2气体的试管倒立于盛水的水槽中,然后通入n mL O2.m>n,则充分反应后,试管中气体在同温同压下的体积为( )| A. | $\frac{m-n}{3}$mL | B. | $\frac{n-m}{3}$mL | C. | $\frac{4m-n}{3}$mL | D. | $\frac{3}{m-n}$mL |
分析 通入水发生反应:3NO2+2H2O=2HNO3+NO,计算得到NO总体积,再通入氧气,又发生反应:4NO+3O2+2H2O=4HNO3,由方程式可知NO有剩余,计算氧气完全反应消耗NO体积,进而计算剩余气体的体积.
解答 解:根据反应3NO2 +2H2O=2HNO3 +NO,可知NO2完全反应得到NO为$\frac{1}{3}$m mL,所以反应后NO气体共(n+$\frac{1}{3}$m)mL,由4NO+3O2 +2H2O=4HNO3,n mL氧气完全反应消耗NO为$\frac{4}{3}$n mL,大于n mL,可知NO有剩余,剩余NO的体积为(n+$\frac{1}{3}$m)mL-$\frac{4}{3}$nmL=$\frac{m-n}{3}$mL,
故选A.
点评 本题考查化学方程式的有关计算,涉及过量计算问题,明确发生的反应即解答,难度不大.

练习册系列答案
相关题目
4.下列溶液中离子一定能大量共存的是( )
| A. | 0.1mol/LNaOH溶液中:Na+、K+、Ca2+、HCO3- | |
| B. | 无色溶液中:H+、Fe2+、Al3+、NO3- | |
| C. | 与铝产生氢气的溶液中:NH4+、Cl-、Mg2+、SO42- | |
| D. | pH>7的溶液中:Na+、K+、AlO2-、SO42- |
5.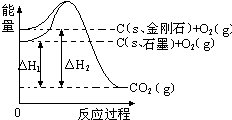 如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
 如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )
如图所示,△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示式正确的是( )| A. | C(s、石墨)=C(s、金刚石)△H=+1.9 kJ•mol-1 | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | 金刚石的稳定性强于石墨 | |
| D. | 石墨和金刚石是同分异构体 |
2.苏轼的《格物粗谈》有这样的记载:“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味.”按照现代科技观点,该文中的“气”是指( )
| A. | 脱落酸 | B. | 乙烯 | C. | 生长素 | D. | 甲烷 |
9.CoCl2•6H2O是一种饲料营养强化剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种新工艺流程如图:
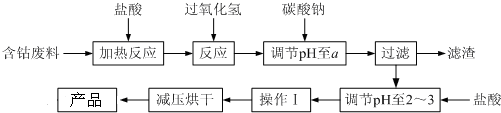
已知:①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为减少氮氧化合物等有毒气体的排放,防止产品中混有硝酸盐.
(2)加入过氧化氢的作用是将Fe2+氧化成Fe3+.
(3)加入碳酸钠调节pH至a,a的范围是5.2~7.6.
(4)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(5)为测定产品中CoCl2•6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量.通过计算发现产品中CoCl2•6H2O的质量分数大于100%,其原因可能是样品中含有NaCl杂质(或烘干时失去了部分结晶水).

已知:①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为减少氮氧化合物等有毒气体的排放,防止产品中混有硝酸盐.
(2)加入过氧化氢的作用是将Fe2+氧化成Fe3+.
(3)加入碳酸钠调节pH至a,a的范围是5.2~7.6.
(4)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(5)为测定产品中CoCl2•6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量.通过计算发现产品中CoCl2•6H2O的质量分数大于100%,其原因可能是样品中含有NaCl杂质(或烘干时失去了部分结晶水).
19.在同温同压下,1mol F2和1mol I2具有相同的( )
| A. | 体积 | B. | 原子数 | C. | 质量 | D. | 质子数. |
18.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 标况下,11.2升CCl4中含有氯原子的数目为2 NA | |
| B. | 500mL 0.5mol/L的Na2CO3溶液中,含有CO32-的数目小于0.25NA | |
| C. | 常温下电解NaNO3溶液,当阳极产生气体22.4升时,转移电子的数目为4NA | |
| D. | 将0.1 mol N2和0.3 mol H2置于密闭容中充分反应,可得0.2NA个NH3分子 |
19.150mL 1mol/L 的氢氧化钠溶液吸收了 2.24L 标准状况下的二氧化碳后,对于溶液中各离子的关系,下列说法错误的是( )
| A. | HCO3-个数多于CO32-个数 | |
| B. | 逐滴加入稀盐酸,刚开始会产生气体 | |
| C. | c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) | |
| D. | 2c(Na+)=3[c(HCO3-)+c(CO32-)+c(H2CO3)] |