题目内容
8.NH3经一系列反应可以得到HNO3,如图所示.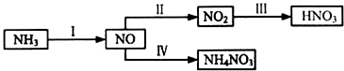
(1)已知反应N2(g)+3H2(g)?2NH3(g)△H,在恒压密闭容器中达到平衡状态.
①根据表中所列键能数据,可得△H=3a+c-6b kJ•mol-1.(用含a、b、c的式子表示)
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | a | b | c |
(2)某温度下,密闭容器发生反应N2O4(g)?2NO2(g),
相互转化时的量变关系如图所示.请回答:
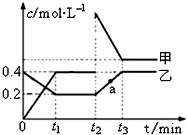
①代表乙的物质是N2O4(填“N2O4”或“NO2”)
②反应进行到t2时刻,改变的条件可能是增大NO2的浓度
③已知:N2(g)+O2(g)?2NO(g)△H=+180.5kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)?CO2(g)△H=-283kJ•mol-1
治理汽车尾气过程中,将NO和CO转化成CO2和N2的反应的热化学方程式为2CO(g)+2NO(g)?2CO2(g)+N2(g)△H=-746.5 kJ•mol-1
(3)电解NO制备 NH4NO3的工作原理如图所示,
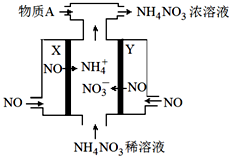
总反应为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3
①NH4NO3溶液中离子浓度由大到小顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-)
②X极的电极反应为NO+6H++5e-=NH4++H2O
③为使电解过程中阳极产生的NO3-与阴极产生的NH4+全部转化为NH4NO3,需补充的物质A为NH3(填化学式)
分析 (1)①根据反应热等于反应物的总键能-生成物的总键能求算;
②恒压密闭容器中,通入氩气,体积增大,反应物的浓度减小;
(2)①甲的浓度变化是乙的二倍,则乙是N2O4;
②反应进行到t2时刻,NO2的浓度突然增大,N2O4的浓度不变;
③根据已知的热化学方程式利用盖斯定律计算;
(3)①NH4NO3溶液中铵根离子水解显酸性,硝酸根离子的浓度大于铵根离子浓度;
②X极上NO得电子生成铵根离子;
③根据电解方程式分析.
解答 解:(1)N2(g)+3H2(g)???2NH3(g)△H=3a+c-6b kJ•mol-1,
故答案为:3a+c-6b;
②恒压密闭容器中,通入氩气,体积增大,反应物的浓度减小,则氮气表示的反应速率减小;
故答案为:减小;
(2)①甲的浓度变化是乙的二倍,由方程式可知,二氧化氮的浓度变化快,所以乙是N2O4;
故答案为:N2O4;
②反应进行到t2时刻,NO2的浓度突然增大,N2O4的浓度不变,所以t2时刻,改变的条件可能是增大NO2的浓度;
故答案为:增大NO2的浓度;
③已知:N2(g)+O2(g)?2NO(g)△H=+180.5kJ•mol-1
CO(g)+$\frac{1}{2}$O2(g)?CO2(g)△H=-283kJ•mol-1
第二个方程乘以2减去第一个方程即可得到:2CO(g)+2NO(g)?2CO2(g)+N2(g)△H=-746.5 kJ•mol-1;
故答案为:2CO(g)+2NO(g)?2CO2(g)+N2(g)△H=-746.5 kJ•mol-1;
(3)①NH4NO3溶液中铵根离子水解显酸性,硝酸根离子的浓度大于铵根离子浓度,所以离子浓度由大到小顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-);
故答案为:c(NO3-)>c(NH4+)>c(H+)>c(OH-);
②②X极上NO得电子生成铵根离子,X极的电极反应为NO+6H++5e-=NH4++H2O;
故答案为:NO+6H++5e-=NH4++H2O;
③由图可知乙为阳极反应为NO-3e-+2H2O=NO3-+4H+,甲为阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3;
故答案为:NH3.
点评 本题考查了反应热的计算、化学平衡移动、离子浓度大小比较、电解原理的应用等,题目涉及的知识点较多,侧重于考查学生的综合运用能力,难度中等,注意基础知识的积累掌握.

| A. | 标况下,11.2升CCl4中含有氯原子的数目为2 NA | |
| B. | 500mL 0.5mol/L的Na2CO3溶液中,含有CO32-的数目小于0.25NA | |
| C. | 常温下电解NaNO3溶液,当阳极产生气体22.4升时,转移电子的数目为4NA | |
| D. | 将0.1 mol N2和0.3 mol H2置于密闭容中充分反应,可得0.2NA个NH3分子 |
| A. | HCO3-个数多于CO32-个数 | |
| B. | 逐滴加入稀盐酸,刚开始会产生气体 | |
| C. | c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) | |
| D. | 2c(Na+)=3[c(HCO3-)+c(CO32-)+c(H2CO3)] |
| A. |  苯的同系物 | B. |  芳香烃 | C. |  卤代烃 | D. |  酯 |

| A. | 导线上电子由Ag极流向石墨极 | B. | 负极电极反应式:Fe3++e-═Fe2+ | ||
| C. | 盐桥中阴离子移向AgNO3溶液 | D. | 总反应为:Fe3++Ag═Fe2++Ag+ |
| A. | 在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) | |
| B. | 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| C. | 含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)=c(HCO${\;}_{3}^{-}$) | |
| D. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 |
 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子. ;五种元素中非金属气态氢化物还原性最强的是H2S(写化学式).
;五种元素中非金属气态氢化物还原性最强的是H2S(写化学式). Fe+2ZG放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极.
Fe+2ZG放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极.