题目内容
15.醋酸亚铬水合物[Cr(CH3COO)2]2.2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂).其制备装置及步骤如下:
①检查装置气密性后,往三颈瓶中依次加入过量锌粒、适量CrCl3溶液.
②关闭k2.打开ki,旋开分液漏斗的旋塞并控制好滴速.
③待三颈瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液转移到装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞.
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到2.76g[Cr(CH3COO)2]2.2H2O.
(1)装置甲中连通管a的作用是使漏斗内的液体顺利滴下.
(2)三颈瓶中的Zn除了与盐酸生成H2外,发生的另一个反应的离子方程式为2Cr3++Zn═2Cr2++Zn2+.
(3)实现步骤③中溶液自动转移至装置乙中的实验操作为打开K2关闭K1.
(4)装置丙中导管口水封的目的是避免空气进入装置乙氧化二价铬.
(5)洗涤产品时,为了去除可溶性杂质和水分,下列试剂的正确使用顺序是b、c、a(填标号).
a.乙醚 b.去氧冷的蒸馏水 c.无水乙醇
(6)若实验所取用的CrCl3溶液中含溶质3.17g,则[Cr(CH3COO)2]2.2H2O(相对分子质量为376)的产率是74.3%.
(7)一定条件下,[Cr(CH3COO)2]2.2H2O受热得到CO和CO2的混合气体,请设计实验检验这两种气体的存在.①混合气体通入澄清石灰水中,变浑浊,说明混合气体中含有CO2;②混合气体通入灼热的CuO,固体颜色由黑色变红色,说明混合气体中有CO.
分析 装置甲:分液漏斗盛装稀盐酸,在圆底烧瓶中和锌反应Zn+2HCl═ZnCl2+H2↑,同时发生2CrCl3+Zn═2CrCl2+ZnCl2,生成氢气,用来增大压强把生成的CrCl2溶液压入装置乙中;装置乙:2Cr2++4CH3COO-+2H2O═[Cr(CH3COO)2]2•2H2O↓,装置丙是保持装置压强平衡,同时避免空气进入.
(1)连通管a利用的是连通器原理,可以使容器内和漏斗上方压强相等;
(2)根据三颈烧瓶中发生的反应的目的是得到Cr2+,这是利用Zn的还原性,据此书写反应方程式;
(3)实验开始生成H2气后,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,打开K2关闭K1,把生成的CrCl2溶液压入装置3中反应;
(4)装置丙中导管口水封的目的是避免空气进入;
(5)醋酸亚铬水合物不溶于冷水和醚,微溶于醇,易溶于盐酸,据此选择洗涤试剂;
(6)CrCl3为0.02mol,得到CrCl2为0.02mol,由原子守恒,根据CrCl2计算[Cr(CH3COO)2]2•2H2O 的理论产量,进而计算其产率;
(7)欲验证混合气体中有CO和CO2,可以结合两气体的性质进行检验,其中CO2能使澄清石灰水变浑浊,而CO有还原性.
解答 解:(1)连通管a使容器内和漏斗上方压强相等,有利于漏斗内的液体顺利滴下,故答案为:使漏斗内的液体顺利滴下;
(2)装置甲:分液漏斗盛装稀盐酸,在圆底烧瓶中和锌反应Zn+2HCl═ZnCl2+H2↑,同时发生2CrCl3+Zn═2CrCl2+ZnCl2,该反应的离子反应为:2Cr3++Zn═2Cr2++Zn2+,
故答案为:2Cr3++Zn═2Cr2++Zn2+;
(3)实验开始生成H2气后,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,打开K2关闭K1,把生成的CrCl2溶液压入装置乙中反应,
故答案为:打开K2关闭K1;
(4)二价铬不稳定,极易被氧气氧化,装置丙中导管口水封的目的是避免空气进入装置乙氧化二价铬,
故答案为:避免空气进入装置乙氧化二价铬;
(5)醋酸亚铬水合物不溶于冷水和醚,微溶于醇,易溶于盐酸,所以可以选用冷水和乙醚洗涤[Cr(CH3COO)2)]2•2H2O产品,最后再用乙醚洗涤干燥,
故答案为:b、c、a;
(6)CrCl3为$\frac{3.17g}{158.5g/mol}$=0.02mol,得到CrCl2为0.02mol,根据原子守恒,则得到[Cr(CH3COO)2]2•2H2O为0.02mol,质量为0.02mol×$\frac{1}{2}$×376g/mol=3.76g,所得产品的产率为$\frac{2.76g}{3.76g}$×100%=73.4%,故答案为:74.3%;
(7)将受热得到的混合气体通入澄清石灰水中,变浑浊,说明混合气体中含有CO2,或将混合气体通入灼热的CuO,固体颜色由黑色变红色,说明混合气体中有CO,故答案为:①混合气体通入澄清石灰水中,变浑浊,说明混合气体中含有CO2;②混合气体通入灼热的CuO,固体颜色由黑色变红色,说明混合气体中有CO.
点评 本题考查物质制备实验,为高频考点,侧重于学生的分析能力和实验能力的考查,涉及化学仪器识别、对操作的分析评价、产率计算、溶度积有关计算、对信息的获取与运用等,注意对题目信息的应用,有利于培养学生分析能力、实验能力,题目难度中等.

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案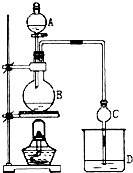 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知 ①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知 ①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点:| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是催化剂、吸水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-;反应结束后D中的现象是溶液分层、上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分液(填操作名称)后,除去乙醇和水;然后对液体混合物进行蒸馏,收集77.1℃左右的馏分,以得到较纯净的乙酸乙酯.
2CH3CH2OH$?_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O
CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O
相关有机化合物的一些性质如下表:
| 分子式 | 相对分子 质量 | 熔点 /℃ | 沸点 /℃ | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | |||||
| CH3COOH | 60 | 16.6 | 117.9 | 1.05 | 互溶 | 互溶 | 互溶 |
| C2H5OH | 46 | -117.3 | 78.5 | 0.8 | 互溶 | / | 互溶 |
| CH3COOC2H5 | 88 | -83.58 | 77.1 | 0.9 | 可溶 | 互溶 | 互溶 |
| C2H5OC2H5 | 74 | -116.2 | 34.51 | 0.7 | 可溶 | 互溶 | / |
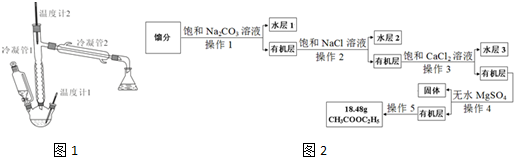
(1)写出实验室制取乙酸乙酯的化学方程式CH3COOH+CH3CH2OH$?_{120-125℃}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O.
(2)①加热三口瓶,最好的方法是C(填选项).
A.水浴 B.酒精灯 C.油浴 D.酒精喷灯
②若滴加液体速度太快会造成多种不利影响,其一是反应液体温度下降过快.
(3)产物提纯的流程如图2:
①操作1的名称是分液,操作5的名称是蒸馏.
②加入饱和Na2CO3溶液的目的是为了除去醋酸.
③加入饱和NaCl溶液是为了除去有机层中少量Na2CO3,其目的是防止生成CaCO3沉淀,在步骤3中堵塞分液漏斗.
④加入饱和CaCl2溶液的目的是为了除去CH3CH2OH,加入无水MgSO4的目的是为了除去水.
⑤乙酸乙酯的产率是80%.
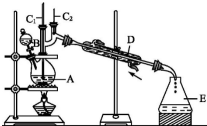 正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4},△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4},△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸气出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由不能,浓硫酸溶于水会放出大量热,容易溅出伤人.
(2)加入沸石的作用是防止液体暴沸.若加热后发现未加沸石,应采取的正确方法是冷却后补加.
(3)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(4)分液漏斗使用前必须进行的操作是C(填正确答案标号).
A.润湿B.干燥 C.检漏 D.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”).
(6)反应温度应保持在90~95℃,其原因是为了将正丁醛及时分离出来,促使反应正向进行,并减少正丁醛进一步氧化.
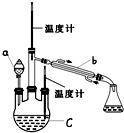 某实验小组用如图所示装置(略去加热装置)制备 乙酸乙酯.
某实验小组用如图所示装置(略去加热装置)制备 乙酸乙酯.(1)仪器C的名称是三颈烧瓶,要向C中加4mL浓硫酸、6mL乙醇、4mL乙酸,
其操作顺序是乙醇、浓硫酸、乙酸.
(2)硫酸分子结构式:
 浓硫酸溶于乙醇不是简单的物理溶解,而是伴随着化学变化,生成硫酸乙酯和硫酸二乙酯,请写出乙醇和硫酸反应生成硫酸二乙酯的方程式2C2H5OH+H2SO4→(OC2H5)2SO2+2H2O.
浓硫酸溶于乙醇不是简单的物理溶解,而是伴随着化学变化,生成硫酸乙酯和硫酸二乙酯,请写出乙醇和硫酸反应生成硫酸二乙酯的方程式2C2H5OH+H2SO4→(OC2H5)2SO2+2H2O.(3)合成乙酸乙酯的反应为放热反应.实验研究表明,反应温度应控制在85℃左右为宜.请根据反应原理分析温度控制的原因:温度低,反应速率低,达不到催化剂活性温度,温度过高;温度过高,利于平衡逆向移动,酯产率降低.
(4)反应完成后,得到粗产品进行除杂.
①把锥形瓶中的粗产品转移到分液漏斗中,加适量的饱和Na2CO3溶液,充分振荡静置,分离时,乙酸乙酯应该从仪器上口倒出(填“下口放出”或“上口倒出”).查阅资料,
相关物质的部分性质:
| 乙醇 | 乙酸 | 乙酸乙酯 | |
| 沸点 | 78.0℃ | 117.9℃ | 77.5℃ |
| 水溶性 | 易溶 | 易溶 | 难溶 |
②为了得到纯度高的产品,一般在①中得到的乙酸乙酯用氯化钙除去其中少量的乙醇,最后用b(选填序号)进行干燥.
a、浓硫酸b、无水硫酸钠c、碱石灰.
| 密度/(g•cm-3) | 沸点/℃ | 水溶性 | |
| 1-丁醇 | 0.81 | 117.7 | 可溶 |
| 乙 酸 | 1.05 | 117.9 | 互溶 |
| 乙酸丁酯 | 0.88 | 126.3 | 微溶 |
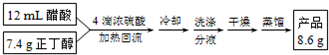
(1)装置a的名称是球形冷凝管,其中冷却水的流动方向是下口进上口出.
(2)制取乙酸丁酯的化学方程式为CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O.加热回流时,分水器中液体分为两层,适时放出水使上层液体流入烧瓶b,从平衡角度考虑,分水器的作用是除去酯化反应生成的水,使生成乙酸丁酯的平衡向正反应方向移动.
(3)反应结束后,把分水器中的酯层和b中的反应液一起倒入分液漏斗中.在分液漏斗中加入10 mL水洗涤,除去下层,上层继续用10 mL 10% Na2CO3溶液洗涤至中性,分液后将上层液体再用10 mL水洗涤,除去溶于酯中的少量无机盐.下列说法不正确的是D(填序号).
A.最初用10 mL水洗涤的目的是除去酸及少量的正丁醇
B.用10 mL 10% Na2CO3洗涤的目的是除去残留的硫酸和乙酸
C.分液时先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口到出
D.分液时先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
(4)在洗涤、分液后的乙酸丁酯中加入少量无水硫酸镁,其目的是除去乙酸丁酯中的水(或干燥乙酸丁酯).
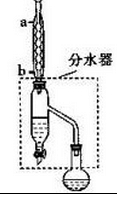
(5)在蒸馏操作中,仪器选择及安装都正确的是C(填标号).
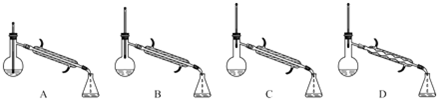
(6)本实验的产率是74%.
| A. | 物质发生化学变化不一定伴随着能量变化 | |
| B. | 硫酸钡、醋酸铵、氨水都是弱电解质 | |
| C. | 向0.1 mol•L-1 Na2CO3溶液中滴加酚酞,溶液变红色 | |
| D. | 在温度、压强一定的条件下,自发反应总是向△H-T△S<0的方向进行 |

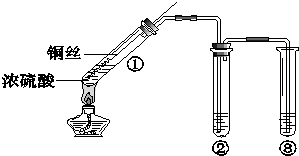 某小组同学探究浓硫酸及其部分反应产物的化学性质,装置如图所示(夹持装置略去).
某小组同学探究浓硫酸及其部分反应产物的化学性质,装置如图所示(夹持装置略去).