题目内容
10.实验室制备乙酸乙酯(CH3COOCH2CH3)时有如下副反应:2CH3CH2OH$?_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O
CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O
相关有机化合物的一些性质如下表:
| 分子式 | 相对分子 质量 | 熔点 /℃ | 沸点 /℃ | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | |||||
| CH3COOH | 60 | 16.6 | 117.9 | 1.05 | 互溶 | 互溶 | 互溶 |
| C2H5OH | 46 | -117.3 | 78.5 | 0.8 | 互溶 | / | 互溶 |
| CH3COOC2H5 | 88 | -83.58 | 77.1 | 0.9 | 可溶 | 互溶 | 互溶 |
| C2H5OC2H5 | 74 | -116.2 | 34.51 | 0.7 | 可溶 | 互溶 | / |
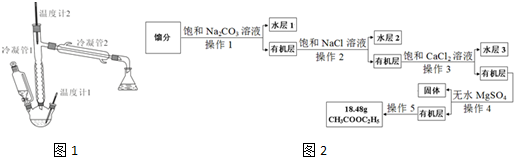
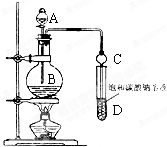
(1)写出实验室制取乙酸乙酯的化学方程式CH3COOH+CH3CH2OH$?_{120-125℃}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O.
(2)①加热三口瓶,最好的方法是C(填选项).
A.水浴 B.酒精灯 C.油浴 D.酒精喷灯
②若滴加液体速度太快会造成多种不利影响,其一是反应液体温度下降过快.
(3)产物提纯的流程如图2:
①操作1的名称是分液,操作5的名称是蒸馏.
②加入饱和Na2CO3溶液的目的是为了除去醋酸.
③加入饱和NaCl溶液是为了除去有机层中少量Na2CO3,其目的是防止生成CaCO3沉淀,在步骤3中堵塞分液漏斗.
④加入饱和CaCl2溶液的目的是为了除去CH3CH2OH,加入无水MgSO4的目的是为了除去水.
⑤乙酸乙酯的产率是80%.
分析 (1)乙酸与乙醇在浓硫酸加热条件下生成乙酸乙酯和水,该反应为可逆反应;
(2)①根据保持反应液体温度在120-125℃,收集馏分判断怎么加热;
②若滴加液体速度太快将导致液体温度下降过快据此分析;
(3)根据制备乙酸乙酯的反应可知,馏分为乙酸、乙醇和乙酸乙酯的混合物,所以加入饱和Na2CO3溶液,则溶解大部分乙醇,反应消耗醋酸,降低乙酸乙酯的溶解性,所以出现分层,则操作1的名称是分液,得到的有机层为含有少量CH3CH2OH和Na2CO3的乙酸乙酯,再加入饱和NaCl溶液除去少量Na2CO3,再分液,得到有机层为含有含有少量CH3CH2OH的乙酸乙酯,因为C2H5OH能与CaCl2生成配合物,所以再加入饱和CaCl2溶液的目的是为了除去C2H5OH,再分液得到含有少量水的乙酸乙酯有机层,所以加入无水MgSO4的目的是为了除去少量水,最后蒸馏得到纯乙酸乙酯18.48g,据此分析解答.
解答 解:(1)乙酸与乙醇在浓硫酸加热条件下生成乙酸乙酯和水,该反应为可逆反应,则反应方程式为:CH3COOH+CH3CH2OH$?_{120-125℃}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH$?_{120-125℃}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;
(2)①因为要保持反应液体温度在120-125℃,所以要好控制温度,并且在120-125℃,所以应选择C.油浴;故选:C;
②若滴加液体速度太快将导致液体温度下降过快,所以不利影响之一为反应液体温度下降过快,不易控制反应温度,故答案为:反应液体温度下降过快;
(3)①根据以上分析,操作1的名称是分液,操作5的名称是蒸馏,故答案为:分液;蒸馏;
②加入饱和Na2CO3溶液的目的溶解大部分乙醇,反应消耗醋酸,降低乙酸乙酯的溶解性,则主要是除去醋酸,故答案为:醋酸;
③因为后面要加入饱和CaCl2溶液除去C2H5OH,所以加入饱和NaCl溶液是为了除去有机层中少量Na2CO3的目的是防止生成CaCO3沉淀,在步骤3中堵塞分液漏斗故答案为:防止生成CaCO3沉淀,在步骤3中堵塞分液漏斗;
④因为C2H5OH能与CaCl2生成配合物,所以再加入饱和CaCl2溶液的目的是为了除去C2H5OH,故答案为:CH3CH2OH;
⑤根据反应CH3COOH+CH3CH2OH$?_{120-125℃}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,则加入了15mL冰醋酸,所以理论上生成CH3COOCH2CH3的质量为$\frac{15ml×1.05g/ml}{60}×88$=23.1g,则乙酸乙酯的产率是$\frac{18.48}{23.1}$×100%=80%,故答案为:80%.
点评 本题考查乙酸乙酯的制备及其分离提纯,难度中等,注意掌握乙酸乙酯的制取原理,明确产物提纯的流程中各步反应的作用.

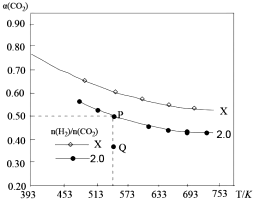 在两个固定容积均为1L密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定容积均为1L密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应在高温下自发进行 | |
| B. | 氢碳比:X<2.0 | |
| C. | 氢碳比为2.0时.Q点v(H2)逆小于P点的v(H2)逆 | |
| D. | 向处于P点状态的容器中,按2:4:1:4的比例再充入CO2、H2、C2H4•H2O,再次平衡后a(CO2)减小 |
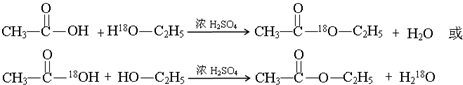 ;
;
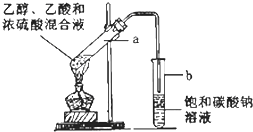 如图为实验室制取乙酸乙酯的装置.请回答:
如图为实验室制取乙酸乙酯的装置.请回答:
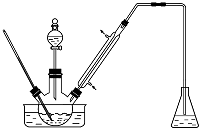 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见如图,相关物质的沸点见附表)其实验步骤为:
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见如图,相关物质的沸点见附表)其实验步骤为: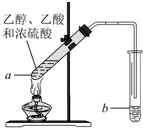 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.