题目内容
下列画有横线的物质,在反应中不能被完全消耗的是( )
①将含有少量H2O(g)的H2通过盛有足量Na2O2的容器中并不断用电火花点燃
②将1molCu置于含2mol H2SO4的浓硫酸中加热
③1mol MnO2与含4mol HCl的浓盐酸加热反应
④密闭体系中,在强光持续照射下,向过量的Ca(ClO)2溶液中通入少量CO2.
①将含有少量H2O(g)的H2通过盛有足量Na2O2的容器中并不断用电火花点燃
②将1molCu置于含2mol H2SO4的浓硫酸中加热
③1mol MnO2与含4mol HCl的浓盐酸加热反应
④密闭体系中,在强光持续照射下,向过量的Ca(ClO)2溶液中通入少量CO2.
| A、①② | B、②③ | C、②④ | D、③④ |
考点:钠的重要化合物,氯、溴、碘及其化合物的综合应用,浓硫酸的性质
专题:元素及其化合物
分析:①将含少量H2O的H2气体通入盛有足量Na2O2的密闭容器中,并不断用电火花引燃,水与过氧化钠反应生成了氧气,会和氢气不断反应,所以氢气能完全消耗;
②铜只与浓硫酸反应与稀硫酸不反应;
③二氧化锰只与浓盐酸反应;
④在强光持续照射下,向过量的Ca(ClO)2的悬浊液中通入少量CO2,二氧化碳与水和Ca(ClO)2反应生成碳酸钙和次氯酸,强光照射次氯酸可完全分解,但Ca(ClO)2不会完全消耗.
②铜只与浓硫酸反应与稀硫酸不反应;
③二氧化锰只与浓盐酸反应;
④在强光持续照射下,向过量的Ca(ClO)2的悬浊液中通入少量CO2,二氧化碳与水和Ca(ClO)2反应生成碳酸钙和次氯酸,强光照射次氯酸可完全分解,但Ca(ClO)2不会完全消耗.
解答:
解:①将含少量H2O的H2气体通入盛有足量Na2O2的密闭容器中,并不断用电火花引燃,2H2O+2Na2O2=4NaOH+O2,2H2+O2=2H2O,氢气能完全消耗,故不选;
②浓硫酸与铜反应,随着反应的进行变为稀硫酸,稀硫酸与铜不反应,故铜不能消耗完全,故选;
③二氧化锰与浓盐酸加热反应,随着反应的进行盐酸浓度降低,变为稀盐酸,稀盐酸与二氧化锰不反应,故二氧化锰有剩余,故选;
④在强光持续照射下,向过量的Ca(ClO)2的悬浊液中通入少量CO2,发生反应Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,光照2HClO=2HCl+O2↑,所以Ca(ClO)2不能完全消耗,故选;
故选BCD.
②浓硫酸与铜反应,随着反应的进行变为稀硫酸,稀硫酸与铜不反应,故铜不能消耗完全,故选;
③二氧化锰与浓盐酸加热反应,随着反应的进行盐酸浓度降低,变为稀盐酸,稀盐酸与二氧化锰不反应,故二氧化锰有剩余,故选;
④在强光持续照射下,向过量的Ca(ClO)2的悬浊液中通入少量CO2,发生反应Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,光照2HClO=2HCl+O2↑,所以Ca(ClO)2不能完全消耗,故选;
故选BCD.
点评:本题考查了常见物质的性质,明确过氧化钠、浓硫酸、次氯酸钙、浓盐酸等物质的性质是解题关键,注意浓度不同产物不同,量不同产物不同,题目难不大.

练习册系列答案
相关题目
 将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合溶液中滴加1mol?L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合溶液中滴加1mol?L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )| A、AB段发生反应的离子方程式为:Ba2++SO42-═BaSO4↓ |
| B、E点对应横坐标稀硫酸的体积为70 mL |
| C、D点表示的沉淀的化学式为Al(OH)3、BaSO4 |
| D、E点沉淀比A点沉淀质量大2.33g |
设NA为阿伏加德罗常数,下列说法中,正确的是( )
| A、2.7g金属铝所含电子数目为0.1 NA |
| B、16 g CH4所含原子数目为NA |
| C、17 g NH3 所含电子数目为NA |
| D、18 g水所含分子数目为NA |
用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、0.1mol/L稀硫酸100mL中含有SO42- 个数为0.1NA |
| B、1.7g NH3所含的电子数目为10NA |
| C、2g H2所含原子数目为2NA |
| D、标准状况下,33.6LSO3含有SO3分子数为1.5NA |
下列说法正确的是( )
A、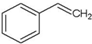 能使溴水褪色,但不能是酸性高锰酸钾溶液褪色 能使溴水褪色,但不能是酸性高锰酸钾溶液褪色 |
| B、乙烯能和溴水、酸性高锰酸钾溶液发生加成反应使之褪色 |
| C、气态烃CxHy与适量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则 y=4 |
| D、相同质量的烃,完全燃烧,消耗O2越多,烃中含碳的质量分数越高 |
下列实验能获得成功的是( )
| A、苯和浓溴水用铁做催化剂制溴苯 |
| B、将苯与浓硝酸混合共热制硝基苯 |
| C、甲烷与氯气光照制得纯净的一氯甲烷 |
| D、乙烯通入溴的四氯化碳溶液得到1,2-二溴乙烷 |


 实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2.
实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2. 研究碳、氮、硫及其化合物的性质具有重要意义.
研究碳、氮、硫及其化合物的性质具有重要意义.