题目内容
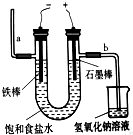
 实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2.
实验室用NaOH和FeSO4制取Fe(OH)2时,Fe(OH)2很容易被氧化,若采用如图所示装置制取,可以得到较纯净的Fe(OH)2.(1)制取前需将Na2SO4溶液煮沸,制取时在Na2SO4溶液上覆盖一层苯的目的是
(2)阳极的电极反应式是:
(3)电解一段时间后,若将电极反接(即铁棒和电源负极相连、石墨棒和电源正极相连),电极反应为:阳极
考点:电解原理
专题:电化学专题
分析:(1)为防止Fe(OH)2被氧化,应隔绝空气;
(2)此装置属于电解池,与正极相连的铁作阳极,发生氧化反应,电极方程式为Fe-2e-=Fe2+,与负极相连的石墨作阴极,发生还原反应,电极方程式为2H++2e-=H2;
(3)反接电源时,电解方程式是2H2O
2H2↑+O2↑,生成的O2会将Fe(OH)2氧化.
(2)此装置属于电解池,与正极相连的铁作阳极,发生氧化反应,电极方程式为Fe-2e-=Fe2+,与负极相连的石墨作阴极,发生还原反应,电极方程式为2H++2e-=H2;
(3)反接电源时,电解方程式是2H2O
| ||
解答:
解:(1)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,故答案为:隔绝空气防止氢氧化亚铁被氧化;
(2)此装置属于电解池,与正极相连的铁作阳极,发生氧化反应,电极方程式为Fe-2e-=Fe2+,与负极相连的石墨作阴极,发生还原反应,电极方程式为2H++2e-=H2;
故答案为:Fe-2e-=Fe2+;2H++2e-=H2;
(2)反接电源时,电解方程式变为2H2O
2H2↑+O2↑,阳极电极方程式为4OH--4e-=O2+2H2O,阴极电极方程式为4H++4e-=2H2;生成的O2会将Fe(OH)2氧化,其现象是白色沉淀迅速变为灰绿色,最终变为红褐色,
故答案为:4OH--4e-=O2+2H2O;4H++4e-=2H2;白色沉淀迅速变为灰绿色,最终变为红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3
(2)此装置属于电解池,与正极相连的铁作阳极,发生氧化反应,电极方程式为Fe-2e-=Fe2+,与负极相连的石墨作阴极,发生还原反应,电极方程式为2H++2e-=H2;
故答案为:Fe-2e-=Fe2+;2H++2e-=H2;
(2)反接电源时,电解方程式变为2H2O
| ||
故答案为:4OH--4e-=O2+2H2O;4H++4e-=2H2;白色沉淀迅速变为灰绿色,最终变为红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3
点评:本题考查氢氧化亚铁的制备和电解原理,明确电解原理及Fe为阳极是解答本题的关键,注意实验中防止氢氧化亚铁被氧化,题目难度不大.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
下列关于电解饱和食盐水制取氯气的说法正确的是( )

| A、通电一段时间后,与正极相连的电极周围的溶液能使酚酞变红 |
| B、与正极相连的电极上有氢气生成 |
| C、与负极相连的电极上有氯气生成 |
| D、为避免电解产物之间发生反应,常用石棉膜或离子交换膜将电解槽分隔成两部分 |
某气态的烷烃与烯烃的混合气体9g,其密度为同状况下H2密度的11.25倍,将混合气体通过足量的溴水,溴水增重4.2g,则原混合气体的组成为( )
| A、甲烷,乙烯 |
| B、乙烷,乙烯 |
| C、甲烷,丙烯 |
| D、甲烷,丁烯 |
 ①若Y是盐酸,则溶液中含有的金属阳离子是
①若Y是盐酸,则溶液中含有的金属阳离子是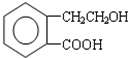 ,它可通过不同化学反应分别制得B、C和D 三种物质.
,它可通过不同化学反应分别制得B、C和D 三种物质.