题目内容
 将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合溶液中滴加1mol?L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合溶液中滴加1mol?L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )| A、AB段发生反应的离子方程式为:Ba2++SO42-═BaSO4↓ |
| B、E点对应横坐标稀硫酸的体积为70 mL |
| C、D点表示的沉淀的化学式为Al(OH)3、BaSO4 |
| D、E点沉淀比A点沉淀质量大2.33g |
考点:离子方程式的有关计算
专题:计算题
分析:由A点可知,A点白色硫酸钡沉淀,则BaCl2过量,由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,混合液中含有钡离子、氢氧根离子、偏铝酸根离子、硫酸根离子,则AB段发生反应生成硫酸钡沉淀和水的反应,BC段发生酸碱中和,CD段发生偏铝酸根离子与酸的反应,DE段发生氢氧化铝与酸的反应,以此来解答.
解答:
解:由A点可知,A点白色硫酸钡沉淀,则BaCl2过量,由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,混合液中含有钡离子、氢氧根离子、偏铝酸根离子、硫酸根离子,
A.由图象可知,AB段发生生成硫酸钡沉淀和水的反应,离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故A错误;
B.CD段发生偏铝酸根离子与酸的反应,DE段发生氢氧化铝与酸的反应,消耗酸的体积之比为1:3,所以DE段消耗酸的体积为30mol,所以E点对应横坐标稀硫酸的体积为70 mL,故B正确;
C、AB段发生反应生成硫酸钡沉淀和水的反应,BC段发生酸碱中和,CD段发生偏铝酸根离子与酸的反应,所以D点表示的沉淀的化学式为Al(OH)3、BaSO4,故C正确;
D、因为最后溶液为Al2(SO4)3和硫酸的混合溶液,E点沉淀比A点沉淀质量大的量就是AB段生成的硫酸钡沉淀的质量,由图可知:消耗酸的量为10ml,所以生成硫酸钡为1mol?L-1×10ml×10-3L/mL=0.01mol,所以E点沉淀比A点沉淀质量为0.01mol×233g/mol=2.33g,故D正确;
故选A.
A.由图象可知,AB段发生生成硫酸钡沉淀和水的反应,离子反应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故A错误;
B.CD段发生偏铝酸根离子与酸的反应,DE段发生氢氧化铝与酸的反应,消耗酸的体积之比为1:3,所以DE段消耗酸的体积为30mol,所以E点对应横坐标稀硫酸的体积为70 mL,故B正确;
C、AB段发生反应生成硫酸钡沉淀和水的反应,BC段发生酸碱中和,CD段发生偏铝酸根离子与酸的反应,所以D点表示的沉淀的化学式为Al(OH)3、BaSO4,故C正确;
D、因为最后溶液为Al2(SO4)3和硫酸的混合溶液,E点沉淀比A点沉淀质量大的量就是AB段生成的硫酸钡沉淀的质量,由图可知:消耗酸的量为10ml,所以生成硫酸钡为1mol?L-1×10ml×10-3L/mL=0.01mol,所以E点沉淀比A点沉淀质量为0.01mol×233g/mol=2.33g,故D正确;
故选A.
点评:本题考查离子反应方程式的书写及图象,难度较大,明确A点的意义及混合液中的离子、离子反应的先后顺序是解答本题的关键.

练习册系列答案
相关题目
干燥剂的干燥性能可用干燥效率(1m3空气中实际余留水蒸气的质量)来衡量.某些干燥剂的干燥效率数据如下分析以上数据,下列有关叙述错误的是.( )
| 物质 | 干燥效率 | 物质 | 干燥效率 |
| MgO | 0.008 | ZnCl2 | 0.8 |
| CaO | 0.2 | ZnBr2 | 1.1 |
| A、MgO的干燥性能比CaO好 |
| B、干燥效率可能与干燥剂的阴、阳离子的半径大小有关 |
| C、MgCl2可能是比CaCl2更好的干燥剂 |
| D、上述干燥剂中阳离子对干燥剂性能的影响比阴离子小 |
下列关于电解饱和食盐水制取氯气的说法正确的是( )
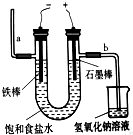

| A、通电一段时间后,与正极相连的电极周围的溶液能使酚酞变红 |
| B、与正极相连的电极上有氢气生成 |
| C、与负极相连的电极上有氯气生成 |
| D、为避免电解产物之间发生反应,常用石棉膜或离子交换膜将电解槽分隔成两部分 |
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A、标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为
| ||
| B、100 mL 0.1 mol/L CH3COOH溶液跟足量锌反应,生成的氢气分子数为0.01 NA | ||
| C、0.1 mol CH4所含质子数为NA | ||
| D、0.5mol C2H4中含有的C=C双键数为NA |