题目内容
 研究碳、氮、硫及其化合物的性质具有重要意义.
研究碳、氮、硫及其化合物的性质具有重要意义.(1)活性炭可以处理NO.在2L的密闭容器中,加人NO和活性碳(无杂质),二者反应生成常见气体E和F.当温度分别为T1和T2时,测得平衡时各物质的量(mol)如下表所示:
| 活性炭 | NO | E | F | |
| 起始 | 2.500 | 0.500 | 0 | 0 |
| T1 | 2.350 | 0.200 | 0.150 | 0.150 |
| T2 | 2.400 | 0.300 | 0.100 | 0.100 |
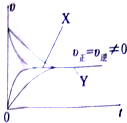
(2)在相同条件下,某同学作出了有催化剂(x)和无催化剂(Y)的速率一时间图象,请你判断该图象是否正确.并说明理由
(3)工业上用可溶性碳酸盐提取锶时,先将SrSO4转化为难容弱酸盐,再处理.
已知:SrSO4(s)?Sr2+(aq)+SO42-(aq) Ksp=2.5×10-7
SrCO3(s)?Sr2+(aq)+CO32-(aq) Ksp=2.5×10-9
写出SrSO4转化为SrCO3的平衡常数表达式
(4)常温下,H2SO3的电离常数Ka1=1.3×10-2,Ka2=6.3×10-8;H2CO3的电离常数 Ka1=4.5×10-2,Ka2=4.7×10-11.将足量的NaHSO3溶液加入到Na2CO3溶液中,反应的离子方程式为
考点:难溶电解质的溶解平衡及沉淀转化的本质,弱电解质在水溶液中的电离平衡,氮的氧化物的性质及其对环境的影响
专题:基本概念与基本理论,元素及其化合物
分析:(1)由表中数据可知,T1时C、NO、E、F的化学计量数之比为0.15:0.3:0.15:0.15=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2;由于正反应是吸热,还是放热不确定,不能判断温度变化;
(2)加入催化剂,反应速率增大;
(3)根据离子方程式SrSO4(s)+CO32-(aq)?SrCO3(s)+SO42-(aq)判断,平衡常数只受温度的影响;
(4)电离平衡常数越大,酸性越强,以此解答.
(2)加入催化剂,反应速率增大;
(3)根据离子方程式SrSO4(s)+CO32-(aq)?SrCO3(s)+SO42-(aq)判断,平衡常数只受温度的影响;
(4)电离平衡常数越大,酸性越强,以此解答.
解答:
解:(1)由表中数据可知,T1时C、NO、E、F的化学计量数之比为0.15:0.3:0.15:0.15=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2,且该反应为可逆反应,故反应方程式为:C+2NO?N2+CO2,由于正反应是吸热,还是放热不确定,不能判断温度变化,
故答案为:C+2NO?N2+CO2;不能确定;
(2)加入催化剂,正逆反应速率应同等程度增大,图象纵坐标为速率,加入催化剂时纵坐标应增大,
故答案为:不正确;使用催化剂,正逆反应速率应同等程度增大且比无催化剂时大;
(3)反应的离子方程式为离子方程式为:SrSO4(s)+CO32-(aq)?SrCO3(s)+SO42-(aq),平衡常数为K=
,平衡常数只受温度的影响,增加离子浓度,平衡常数不变,故答案为:K=
;不变;
(4)由于平衡常数H2CO3的Ka1>H2SO3的Ka2>H2CO3的Ka2,则酸性H2CO3>HSO3->HCO3-,将足量的NaHSO3溶液加入到Na2CO3溶液中反应生成SO32-和HCO3-,反应的离子方程式为HSO3-+CO32-=SO32-+HCO3-,
故答案为:HSO3-+CO32-=SO32-+HCO3-;通过电离平衡常数可知酸性强弱为:H2CO3>HSO3->HCO3-,因而HSO3-与CO32-反应生成SO32-和HCO3-,不能放出二氧化碳.
故答案为:C+2NO?N2+CO2;不能确定;
(2)加入催化剂,正逆反应速率应同等程度增大,图象纵坐标为速率,加入催化剂时纵坐标应增大,
故答案为:不正确;使用催化剂,正逆反应速率应同等程度增大且比无催化剂时大;
(3)反应的离子方程式为离子方程式为:SrSO4(s)+CO32-(aq)?SrCO3(s)+SO42-(aq),平衡常数为K=
| [SO42-] |
| [CO32-] |
| [SO42-] |
| [CO32-] |
(4)由于平衡常数H2CO3的Ka1>H2SO3的Ka2>H2CO3的Ka2,则酸性H2CO3>HSO3->HCO3-,将足量的NaHSO3溶液加入到Na2CO3溶液中反应生成SO32-和HCO3-,反应的离子方程式为HSO3-+CO32-=SO32-+HCO3-,
故答案为:HSO3-+CO32-=SO32-+HCO3-;通过电离平衡常数可知酸性强弱为:H2CO3>HSO3->HCO3-,因而HSO3-与CO32-反应生成SO32-和HCO3-,不能放出二氧化碳.
点评:本题考查较为综合,涉及平衡常数、难溶电解质的溶解平衡等相关知识,题目难度中等,试题有利于培养学生的分析、理解能力及灵活应用所学知识的能力,注意相关基础知识的积累.

练习册系列答案
相关题目
取20g混有二氧化锰的氯酸钾,加热至恒重.在一定温度下将残留的固体加入10g水中有7.9g固体未溶解,再加入5g水有5.3g固体残渣未溶,再加水,残渣不减少.则原混合物中可能含有的KClO3质量为( )
| A、14.7g | B、6.9g |
| C、12.1g | D、17.6g |
用NA代表阿伏加德罗常数,下列有关叙述正确的是( )
| A、含1molH2O的冰中含氢键数为2NA |
| B、12g金刚石中含有C-C键的个数为4NA |
| C、6g SiO2晶体中硅氧共价键数0.2NA |
| D、28gC2H4中含有的σ键为4NA |
下列说法正确的是( )
| A、两种难溶物中溶解度小的物质其Ksp不一定小 |
| B、同种酸形成的酸式盐溶解度一定比正盐的溶解度大 |
| C、非金属性越强的元素其含氧酸酸性越强 |
| D、强电解质溶液的导电能力一定比弱电解质溶液导电能力强 |
只用下列试剂的一种就能将K2S、BaCl2、KAlO2、Al(NO3)3、Na2CO3五种溶液区别出来的试剂是( )
| A、硝酸 | B、盐酸 |
| C、氢氧化钠 | D、硫酸 |