题目内容
下列说法正确的是( )
A、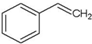 能使溴水褪色,但不能是酸性高锰酸钾溶液褪色 能使溴水褪色,但不能是酸性高锰酸钾溶液褪色 |
| B、乙烯能和溴水、酸性高锰酸钾溶液发生加成反应使之褪色 |
| C、气态烃CxHy与适量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则 y=4 |
| D、相同质量的烃,完全燃烧,消耗O2越多,烃中含碳的质量分数越高 |
考点:有机物分子中的官能团及其结构,乙烯的化学性质
专题:有机物的化学性质及推断
分析:A、有机物中含有烯烃官能团碳碳双键,具有烯烃的性质,据此回答;
B、乙烯能和溴水之间发生加成反应,能被高锰酸钾氧化;
C、根据燃烧通式CxHy+(x+
)O2
xCO2+
H2O进行分析;
D、由C+O2
CO2,4H+O2→2H2O可知,消耗32g氧气需要碳12g,需要H元素4g,故等质量时,有机物含氢量越大,燃烧时消耗氧气越多.
B、乙烯能和溴水之间发生加成反应,能被高锰酸钾氧化;
C、根据燃烧通式CxHy+(x+
| y |
| 4 |
| 点燃 |
| y |
| 2 |
D、由C+O2
| ||
解答:
解:A、该有机物中含有烯烃官能团碳碳双键,能使溴水褪色,但不能是酸性高锰酸钾溶液褪色,故A错误;
B、乙烯能和溴水发生加成反应使之褪色,和酸性高锰酸钾溶液发生氧化反应而使之褪色,故B错误;
C、根据通式分析CxHy+(x+
)O2
xCO2+
H2O,可知如果反应前后气体体积不变,则1+x+
=x+
,即y=4,故C正确;
D、由C+O2
CO2,4H+O2→2H2O可知,消耗32g氧气需要碳12g,需要H元素4g,故等质量时,有机物含氢量越大,燃烧时消耗氧气越多,故D错误;
故选:C.
B、乙烯能和溴水发生加成反应使之褪色,和酸性高锰酸钾溶液发生氧化反应而使之褪色,故B错误;
C、根据通式分析CxHy+(x+
| y |
| 4 |
| 点燃 |
| y |
| 2 |
| y |
| 4 |
| y |
| 2 |
D、由C+O2
| ||
故选:C.
点评:本题考查有机物的结构与性质,为高频考点,把握有机物中的官能团及官能团与性质的关系为解答的关键,侧重常见有机物性质的考查,题目难度不大.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A、标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为
| ||
| B、100 mL 0.1 mol/L CH3COOH溶液跟足量锌反应,生成的氢气分子数为0.01 NA | ||
| C、0.1 mol CH4所含质子数为NA | ||
| D、0.5mol C2H4中含有的C=C双键数为NA |
下列说法正确的是( )
| A、两种难溶物中溶解度小的物质其Ksp不一定小 |
| B、同种酸形成的酸式盐溶解度一定比正盐的溶解度大 |
| C、非金属性越强的元素其含氧酸酸性越强 |
| D、强电解质溶液的导电能力一定比弱电解质溶液导电能力强 |
蒽 的一氯取代物其同分异构体的种类有( )
的一氯取代物其同分异构体的种类有( )
 的一氯取代物其同分异构体的种类有( )
的一氯取代物其同分异构体的种类有( )| A、2种 | B、3种 | C、4种 | D、5种 |
常温下,向体积为1 0mL、物质的量浓度均为0.1mol/L的盐酸和醋酸的混合溶液中滴入0.1mol/L NaOH溶液.下列说法错误的是( )
| A、加入NaOH溶液后,溶液一定满足:c(H+)+c(Na+)═c(OH-)+c(C1-)+c(CH3COO-) |
| B、加入10 mLNaOH溶液时,溶液满足(溶液体积变化忽略不计):c(CH3COO-)+c(CH3COOH)=0.05 mol/L |
| C、加入15 mLNaOH溶液时,呈酸性,溶液满足:c(Na+)>c(C1-)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| D、加入足量NaOH溶液时,溶液中发生的中和反应的热化学方程式表示为:H+(aq)+OH-(aq)═H2O(1)△H=一57.3 kJ?mol-1 |
二氧化硅属于酸性氧化物的理由主要是( )
| A、硅是非金属元素 |
| B、二氧化硅对应的水化物是可溶性弱酸 |
| C、二氧化硅能和强碱反应生成盐和水 |
| D、二氧化硅不能与酸反应 |