题目内容
13.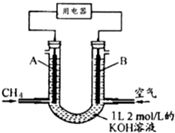 CH4燃料电池,装置示意如图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当0<V<44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O.
CH4燃料电池,装置示意如图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当0<V<44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O.
分析 n(KOH)=2mol/L×1L=2mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;根据甲烷的量计算生成的二氧化碳的量,结合反应方程式判断反应产物及发生的反应,由此分析解答.
解答 解:n(KOH)=2mol/L×1L=2mol,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3;
当0<V<44.8 L时,0<n(CH4)<2mol,则0<n(CO2)<2mol,只发生反应①②,且KOH过量,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O,
故答案为:CH4+2O2+2KOH=K2CO3+3H2O.
点评 本题考查了通过计算书写燃料电池的电极反应式、溶液中离子浓度大小关系等重要考点,涉及的知识点较多,综合性较强,难度较大.

练习册系列答案
相关题目
3.下列说法正确的是( )
| A. | pH在5.6~7.0之间的降水通常称为酸雨 | |
| B. | 海水资源的利用包括水资源的利用和化学资源的利用,两者可以综合进行 | |
| C. | 工业上用电解饱和氯化钠溶液的方法制得金属钠 | |
| D. | 含磷合成洗涤剂易于被细菌分解,故不会导致水体污染 |
1.合金在现代生产、生活中应用非常广泛,因为它有许多优良的特性,下列关于合金性质的说法错误的是( )
| A. | 多数合金的硬度一般比其各成分金属的硬度高 | |
| B. | 多数合金的熔点一般比其各成分金属的熔点低 | |
| C. | 合金中可以含有非金属元素 | |
| D. | 合金的化学性质一般与其各成分金属的化学性质不同 |
18.下列说法正确的是( )
| A. | Mg、Al在空气中性质稳定,因而都具有很强的抗腐蚀性 | |
| B. | 质量数相等的不同核素,一定属于不同种元素 | |
| C. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 | |
| D. | 自行车钢架生锈主要是化学腐蚀所致 |
5. 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、Na+、Mg2+、Fe3+、Al3+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、Na+、Mg2+、Fe3+、Al3+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生.
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g.
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.
根据上述实验,以下推测不正确的是( )
 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、Na+、Mg2+、Fe3+、Al3+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、Na+、Mg2+、Fe3+、Al3+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:①第一份加足量AgNO3溶液后,有白色沉淀产生.
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g.
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.
根据上述实验,以下推测不正确的是( )
| A. | 原溶液一定不存在H+、Fe3+、CO32- | |
| B. | 不能确定原溶液是否含有Na+、Cl- | |
| C. | 实验所加的NaOH的浓度为2mol•L-1 | |
| D. | 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2 |
3.锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一.从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
①2Sb2S3+3O2+6Fe═Sb4O6+6FeS ②Sb4O6+6C═4Sb+6CO
关于反应①、②的说法正确的是( )
①2Sb2S3+3O2+6Fe═Sb4O6+6FeS ②Sb4O6+6C═4Sb+6CO
关于反应①、②的说法正确的是( )
| A. | 反应①②中的氧化剂分别是Sb2S3、Sb4O6 | |
| B. | 反应①中每生成3 mol FeS时,共转移6 mol电子 | |
| C. | 反应②说明高温下Sb的还原性比C强 | |
| D. | 每生成4 mol Sb时,反应①与反应②中还原剂的物质的量之比为4:3 |

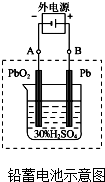 (1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O
(1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O (1)由下列物质冶炼相应金属时采用电解法的是bd.
(1)由下列物质冶炼相应金属时采用电解法的是bd.