题目内容
5. 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、Na+、Mg2+、Fe3+、Al3+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、Na+、Mg2+、Fe3+、Al3+、Cl-、CO32-、SO42-,现取三份100mL溶液进行如下实验:①第一份加足量AgNO3溶液后,有白色沉淀产生.
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g.
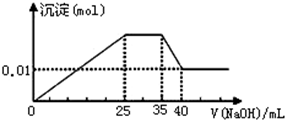
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.
根据上述实验,以下推测不正确的是( )
| A. | 原溶液一定不存在H+、Fe3+、CO32- | |
| B. | 不能确定原溶液是否含有Na+、Cl- | |
| C. | 实验所加的NaOH的浓度为2mol•L-1 | |
| D. | 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2 |
分析 溶液是无色透明的,所以不含有颜色的离子,故Fe3+一定不存在;
通过图象知,在加入过量的NaOH的过程中,一开始就有沉淀生成,说明不含有H+;沉淀部分溶解,推断一定含有Al3+;K+不能和中学常见物质反应产生特殊现象进行判断,只能用焰色反应判断,则不能确定是否含Na+;
①第一份加足量AgNO3溶液后,有白色沉淀产生,推断一定有CO32-、SO42-两种中的一种.因通过图象知含有Al3+;铝离子和碳酸根离子发生双水解,不能共存,所以推断一定不含有CO32-、一定含有SO42-;
②第二份加足里BaCl2 溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g,推断生成3×10-2molBaSO4,所以n(SO42-)=3×10-2mol;
③第三份逐滴滴加NaOH 溶液,测得沉淀与NaOH溶液的体积关系如图,通过图象知,在加入过量的过氧化钠的过程中,一开始就有沉淀生成,说明不含有H+,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3•H2O,最后溶液中有沉淀,说明溶液中含Mg2+,通过此实验无法判断是否含有Na+,以此解答.
解答 解:溶液是无色透明的,所以不含有颜色的离子,故Fe3+一定不存在;
通过图象知,在加入过量的NaOH的过程中,一开始就有沉淀生成,说明不含有H+;沉淀部分溶解,推断一定含有Al3+;K+不能和中学常见物质反应产生特殊现象进行判断,只能用焰色反应判断,则不能确定是否含Na+;
①第一份加足量AgNO3溶液后,有白色沉淀产生,推断一定有CO32-、SO42-两种中的一种.因通过图象知含有Al3+;铝离子和碳酸根离子发生双水解,不能共存,所以推断一定不含有CO32-、一定含有SO42-;
②第二份加足里BaCl2 溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g,推断生成3×10-2molBaSO4,所以n(SO42-)=3×10-2mol;
③第三份逐滴滴加NaOH 溶液,测得沉淀与NaOH溶液的体积关系如图,通过图象知,在加入过量的过氧化钠的过程中,一开始就有沉淀生成,说明不含有H+,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3•H2O,最后溶液中有沉淀,说明溶液中含Mg2+,通过此实验无法判断是否含有Na+,
A.由上述分析可知,原溶液一定不存在H+、Fe3+、CO32-,故A正确;
B.原溶液确定含有Mg2+、Al3+、NH4+,由图可知,沉淀最大时是氢氧化镁、氢氧化铝沉淀,且n[Mg(OH)2]+n[Al(OH)3]=0.02mol,沉淀最小时,为氢氧化镁,故n[Mg(OH)2]=0.01mol,故n[Al(OH)3]=0.02mol-0.01mol=0.01mol,根据铝元素守恒可知n(Al3+)=n[Al(OH)3]=0.01mol,根据Al3++3OH-=Al(OH)3↓,需OH-0.03mol;根据镁元素守恒可知原溶液中n(Mg2+)=n[Mg(OH)2]=0.01mol,根据Mg2++2OH-=Mg(OH)2↓,需OH-0.02mol;生成沉淀最大量时需OH-0.05mol,由图可知消耗Na0H25mL,所以c(Na0H )=$\frac{n}{V}$=$\frac{0.05mol}{0.025L}$=2mol•L-1;根据NH4++OH-=NH3•H2O,所以可得到NH4+的物质的量为0.01L×2mol•L-1=2×10-2mol,则n(Mg2+):n(Al3+):n(NH4+):n(SO42-)═0.01mol:0.01mol:2×10-2mol:3×10-2mol=1:1:2:3,由电荷守恒可知1×2+1×3+2×1>3×2,则应存在Cl-,故B错误;
C.由选项B的计算可知,实验所加的NaOH的浓度为2mol•L-1,故C正确;
D.由选项B的计算可知,原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n(NH4+)=1:1:2,故D正确;
故选B.
点评 本题考查离子反应的计算,为高频考点,涉及图象分析、离子共存及物质的量计算等,侧重分析能力及计算能力的综合考查,把握图中曲线对于的反应为解答的关键,题目难度较大,选项B中利用电荷守恒为解答的易错点,题目难度较大.

 星级口算天天练系列答案
星级口算天天练系列答案| A. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 | |
| B. | 铁片镀锌时,铁片与外电源的正极相连 | |
| C. | 以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,$\frac{c(NO)•c(S{O}_{3})}{c(N{O}_{2})•c(S{O}_{2})}$的值及SO2转化率不变 |
①形成化学键的过程一定是化学变化
②铁分别与氯气和稀盐酸反应所得的氯化物相同
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④常温下,pH=12的溶液一定能大量存在:K+、Cl-、SO32-、S2-
⑤在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是:范德华力、共价键、共价键.
| A. | ①②③⑤ | B. | ②③④ | C. | ①③④ | D. | ①②④⑤ |
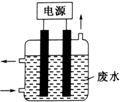 用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | ClO-将CN-氧化过程中,每消耗1molCN-转移10mol电子 | |
| B. | 阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极的电极反应式为:2H2O+2e-═H2↑+2OH- | |
| D. | 在电解过程中,废水中CN-和Cl-均移向阳极 |

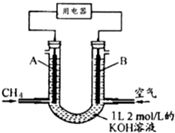 CH4燃料电池,装置示意如图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当0<V<44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O.
CH4燃料电池,装置示意如图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当0<V<44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O.
 铝和硫的单质及其化合物在工农业生产和生活中有重要的作用.
铝和硫的单质及其化合物在工农业生产和生活中有重要的作用.