题目内容
3.锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一.从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:①2Sb2S3+3O2+6Fe═Sb4O6+6FeS ②Sb4O6+6C═4Sb+6CO
关于反应①、②的说法正确的是( )
| A. | 反应①②中的氧化剂分别是Sb2S3、Sb4O6 | |
| B. | 反应①中每生成3 mol FeS时,共转移6 mol电子 | |
| C. | 反应②说明高温下Sb的还原性比C强 | |
| D. | 每生成4 mol Sb时,反应①与反应②中还原剂的物质的量之比为4:3 |
分析 ①2Sb2S3+3O2+6Fe=Sb4O6+6FeS中,O和Fe化合价发生变化,O2为氧化剂,Fe为还原剂;
②Sb4O6+6C=4Sb+6CO中Sb和C的化合价发生变化,Sb4O6为氧化剂,C为还原剂;
从化合价的角度分析氧化还原反应,注意氧化剂和还原剂的分析.
解答 解:A.反应①O2为氧化剂,②中Sb4O6为氧化剂,故A错误;
B.①2Sb2S3+3O2+6Fe=Sb4O6+6FeS中,每生成6molFeS时,共转移12mol电子,则每生成3molFeS时,共转移6mol电子,故B正确;
C.反应②说明高温下Sb的还原性比C弱,故C错误;
D.每生成4molSb时,反应①与反应②中还原剂的物质的量之比为1:1,故D错误.
故选B.
点评 本题考查氧化还原反应知识,题目难度不大,本题注意从氧化还原反应的角度分析,注意氧化剂和还原剂的判断.

练习册系列答案
相关题目
11.下列化学用语表示正确的是( )
| A. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| B. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| C. | Na2O2的电子式: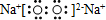 | |
| D. | 乙烯分子的结构简式:CH2CH2. |
18.中学化学很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是( )
| A. | 根据弱酸越稀越电离的规律,0.2mol•L-1 CH3COOH的pH值比0.1mol•L-1 CH3COOH的 pH值大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
8.化学与生产、生活密切相关.下列说法正确的是( )
| A. | 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 | |
| B. | 大力实施矿物燃料“脱硫、脱销技术”,减少硫的氧化物和氮的氧化物污染 | |
| C. | 用聚氯乙烯代替木材,生产包装盒、快餐盒等,以减少木材的使用 | |
| D. | 氢氧燃料电池、硅太阳能电池中都利用了原电池原理 |
15.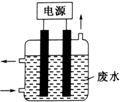 用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
 用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | ClO-将CN-氧化过程中,每消耗1molCN-转移10mol电子 | |
| B. | 阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极的电极反应式为:2H2O+2e-═H2↑+2OH- | |
| D. | 在电解过程中,废水中CN-和Cl-均移向阳极 |
12.下列离子方程式正确的是( )
| A. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| B. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | 向0.3mol/LNaClO溶液中滴加等体积的0.2mol/LNaHSO3溶液:2HSO3-+4ClO-═2SO42-+2Cl-+2HClO | |
| D. | 向碘化亚铁溶液中滴加溴的四氯化碳溶液2Br2+2Fe2++2I-═I2+4Br-+2Fe3+ |
13.下列溶液中微粒浓度关系一定正确的是( )
| A. | 0.1mol/L的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) | |
| B. | 室温下,pH=7的醋酸和醋酸钠的混合溶液中:c(CH3COO-)>c(Na+) | |
| C. | 将水加热到100℃,pH=6:c(H+)>c(OH-) | |
| D. | 同浓度的三种溶液:①CH3COONH4 ②NH4Cl ③NH3•H2O中,c(NH4+)由大到小的顺序是②③① |
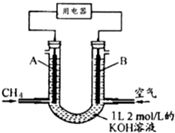 CH4燃料电池,装置示意如图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当0<V<44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O.
CH4燃料电池,装置示意如图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.当0<V<44.8L时,电池总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O.