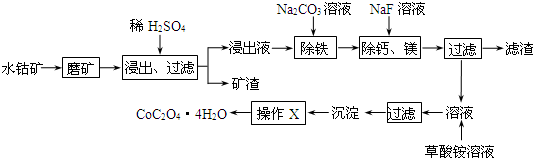
题目内容
标准状况下,5.6L的氧气与臭氧的混合气体通过松节油(松节油只吸收臭氧),松节油的质量增加了4.8g,则原混合气体中氧气的体积是多少?
考点:物质的量的相关计算
专题:
分析:松节油的质量增加了4.8g,则臭氧的质量为4.8g,其物质的量为
=0.1mol,混合气体的物质的量为
=0.25mol,以此计算氧气的量.
| 4.8g |
| 48g/mol |
| 5.6L |
| 22.4L/mol |
解答:
解:松节油的质量增加了4.8g,则臭氧的质量为4.8g,其物质的量为
=0.1mol,标准状况下,5.6L的氧气与臭氧的混合气体,混合气体的物质的量为
=0.25mol,则原混合气体中氧气的体积是(0.25mol-0.1mol)×22.4L/mol=3.36L,
答:原混合气体中氧气的体积是3.36L.
| 4.8g |
| 48g/mol |
| 5.6L |
| 22.4L/mol |
答:原混合气体中氧气的体积是3.36L.
点评:本题考查物质的量的计算,为高频考点,把握质量、体积与物质的量的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案
相关题目
P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是( )
| A、NH3 |
| B、HI |
| C、H2S |
| D、SO2 |
下列说法正确的是( )
| A、1 mol氧 |
| B、SO42-的摩尔质量是96 g |
| C、3 mol小麦 |
| D、标准状况下,1 mol O2 |
下列装置或操作能达到目的是( )
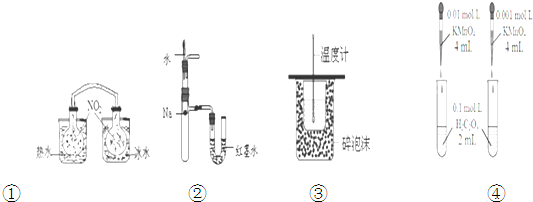

| A、装置①依据两容器内气体颜色变化,不能判断反应2NO2(g)?N2O4(g)平衡移动的方向 |
| B、装置②依据U管两边液面的高低判断Na和水反应的热效应 |
| C、装置③测定中和热 |
| D、装置④依据褪色快慢比较浓度对反应速率的影响 |
用蒸馏水稀释0.1mol/L醋酸时,始终保持增大趋势的是( )
| A、溶液中的c(CH3COO-) |
| B、溶液中的c(H+) |
| C、醋酸的电离平衡常数 |
| D、溶液中的c(OH-) |
对于某些离子的检验及结论一定正确的是( )
| A、取样,加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| B、取样,加入硝酸银有白色沉淀,一定有Cl- |
| C、取样,加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| D、取样,滴加KSCN溶液,不显红色,再滴加氯水后显红色,一定有Fe2+ |