题目内容
11.下列转化关系中,X、Y是生活中用途广泛的两种金属单质,A、B是氧化物,A为红棕色固体,C、D、E是中学常见的三种化合物.分析转化关系回答问题.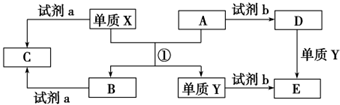
(1)请写出反应①的化学方程式:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
(2)由D到E的离子方程式Fe+2Fe3+=3 Fe2+.
(3)若试剂a是NaOH溶液,写出单质X与NaOH溶液反应的离子方程式2Al+2H2O+2OH-═2AlO2-+3H2↑.
(4)若试剂b是H2SO4,工业上用E、H2SO4和NaNO2为原料制取高效净水剂Y(OH)SO4,已知还原产物为NO,则该反应的化学方程式是2FeSO4+H2SO4+2NaNO2=2Fe(OH)SO4+Na2SO4+2NO↑.
(5)工业上电解熔融的B制取X时,若阳极产生的气体在标准状况下的体积为33.6L,则阴极产物的质量为54g.
分析 X、Y是生活中用途广泛的两种金属单质,A、B是氧化物,X与A反应得到B与Y,A为红棕色固体,则A为Fe2O3,X与A的反应为铝热反应,则X为Al、Y为Fe、B为Al2O3,试剂a为NaOH溶液时,C为NaAlO2;试剂b为硫酸时,D为硫酸铁、E为硫酸亚铁,据此解答.
解答 解:X、Y是生活中用途广泛的两种金属单质,A、B是氧化物,X与A反应得到B与Y,A为红棕色固体,则A为Fe2O3,X与A的反应为铝热反应,则X为Al、Y为Fe、B为Al2O3,试剂a为NaOH溶液时,C为NaAlO2;试剂b为硫酸时,D为硫酸铁、E为硫酸亚铁.
(1)反应①的化学方程式:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,故答案为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(2)由D到E的离子方程式:Fe+2Fe3+=3 Fe2+,故答案为:Fe+2Fe3+=3 Fe2+;
(3)若试剂a是NaOH溶液,单质Al与NaOH溶液反应的离子方程式:2Al+2H2O+2OH-═2AlO2-+3H2↑,
故答案为:2Al+2H2O+2OH-═2AlO2-+3H2↑;
(4)若试剂b是H2SO4,工业上用FeSO4、H2SO4和NaNO2为原料制取高效净水剂Fe(OH)SO4,已知还原产物为NO,则该反应的化学方程式是:2FeSO4+H2SO4+2NaNO2=2Fe(OH)SO4+Na2SO4+2NO↑,
故答案为:2FeSO4+H2SO4+2NaNO2=2Fe(OH)SO4+Na2SO4+2NO↑;
(5)工业上电解熔融的Al2O3制取Al时,若阳极产生的气体为氧气,氧气物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol,根据电子转移守恒可知阴极生成Al为$\frac{1.5mol×4}{3}$=2mol,则阴极产物的质量为2mol×27g/mol=54g,
故答案为:54g.
点评 本题考查无机物的推断,涉及Fe、Al元素单质化合物的性质,注意对铝热反应的掌握,在推断中经常涉及,难度中等.

①最高正价为+6价能与氢形成气氢化物
②最外层电子数为1,并且有+1价、+2两种化合价
③除最外层外,其余各电子层都达到了饱和
④最外层电子数是次外层电子数的3倍
⑤最外层电子数为3的一种元素
⑥能形成气态氢化物的一种元素
⑧最高价氧化物对应的水化物是酸的一种元素.
| A. | ①③⑤⑥⑦ | B. | ②④⑥⑦ | C. | ④⑤⑥ | D. | ①③④⑤⑥⑦ |
| A. | 离子半径:Q>W>Z>Y | |
| B. | 元素Y、Q的气态氢化物稳定性:Q>Y | |
| C. | 元素Z、W、Q的最高价氧化物对应水化物相互间能发生反应 | |
| D. | Y与X、Y与Z形成的化合物化学键类型相同. |
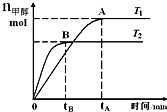 在恒容密闭的容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
在恒容密闭的容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )| A. | 处于A点的反应体系从T1变到T2,达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大 | |
| B. | CO合成甲醇的反应为吸热反应 | |
| C. | 该反应在T1时的平衡常数比T2时的小 | |
| D. | 该反应平衡常数可表示为K=$\frac{c(C{H}_{3}OH)}{c(CO)c({H}_{2})}$ |
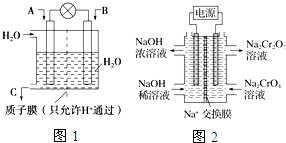
| A. | 与足量的澄清石灰水反应的现象不同 | |
| B. | 通入BaCl 2溶液时现象相同 | |
| C. | 通入Ba(NO3)₂溶液时现象相同 | |
| D. | 通入石蕊溶液时现象相同 |
 SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径.
SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径.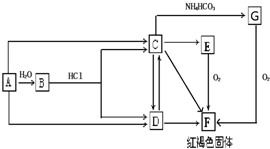
 甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料.甲醇在各个领域有着广泛的应用.
甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料.甲醇在各个领域有着广泛的应用.