题目内容
18.如图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系.下列说法一定正确的是( )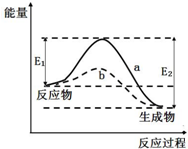
| A. | 该反应△H>0 | B. | a与b相比,a的反应速率更快 | ||
| C. | a与b相比,反应的平衡常数Ka=Kb | D. | 反应物总键能大于生成物总键能 |
分析 A.反应物的总能量大于生成物的总能量为放热反应;
B.催化剂能降低反应的活化能,加快反应的速率;
C.催化剂只改变反应速率,不影响化学平衡常数;
D.反应物总键能E1小于生成物总键能E2.
解答 解:A.反应物的总能量大于生成物的总能量为放热反应,△H<0,故A错误;
B.b降低了活化能,反应速率升高,故B错误;
C.催化剂只改变反应速率,不改变平衡状态,a与b反应的平衡常数相同,故C正确;
D.由图可知,反应物总键能E1小于生成物总键能E2,故D错误.
故选C.
点评 本题考查吸热反应和放热反应,注意催化剂只改变反应速率,不改变平衡状态,题目较简单.

练习册系列答案
 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
8.下列物质中,只含共价键的化合物是( )
| A. | N2 | B. | CO2 | C. | MgO | D. | NaOH |
9.关于甲酸(HCOOH)的下列性质中,不能证明它是弱电解质的是( )
| A. | 把pH=2的甲酸溶液稀释100倍后pH=3.5 | |
| B. | 50mL l mol•L-1的甲酸溶液恰好与50mL l mol•L-1的NaOH溶液完全反应 | |
| C. | HCOONa溶液能使酚酞试液变红 | |
| D. | 0.1 mol•L-1的甲酸溶液的pH约为2 |
6.已知25℃时有关弱酸的电离平衡常数:
则下列有关说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Ma2CO3)>pH(CH3COONa) | |
| B. | amol/L HCN 溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则一定a大于b | |
| C. | 冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离(程)度、c(H+)均先增大后减小 | |
| D. | NaHCO3和Na2CO3的混合溶液中,一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
13.下列各组离子能在指定溶液中大量共存的是( )
| A. | pH=14的溶液中:CO32-、Na+、S2-、AlO2- | |
| B. | 室温下水电离的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| C. | 室温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Fe2+、Al3+、NO3-、I- | |
| D. | 无色溶液中:Al3+、NH4+、Cl?、HCO3? |
10.下列说法正确的是( )
| A. | SO2使紫色石蕊溶液变红色:SO2+H2O═2H++SO32- | |
| B. | 在任何条件下都不能发生Cu+H2SO4═CuSO4+H2↑反应 | |
| C. | FeCl3、Na2O2、Cu2S均可由相应单质直接化合生成 | |
| D. | 浓度和体积相同的FeBr2、FeI2溶液中,分别通入少量氯气都首先发生置换反应 |
7.鉴别MgSO4、Al2(SO4)3、Fe2(SO4)3、(NH4)2SO4四种溶液,最好选择下列试剂中的( )
| A. | KSCN溶液 | B. | NaOH溶液 | C. | 氨水 | D. | 石蕊试液 |
6.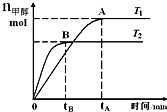 在恒容密闭的容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
在恒容密闭的容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
 在恒容密闭的容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
在恒容密闭的容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )| A. | 处于A点的反应体系从T1变到T2,达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大 | |
| B. | CO合成甲醇的反应为吸热反应 | |
| C. | 该反应在T1时的平衡常数比T2时的小 | |
| D. | 该反应平衡常数可表示为K=$\frac{c(C{H}_{3}OH)}{c(CO)c({H}_{2})}$ |
 SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径.
SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径.