题目内容
15.干电池原理示意图如图,电池总反应为:Zn+2NH4+═Zn2++2NH3↑+H2↑,下列说法正确的是( )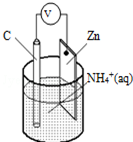
| A. | 碳为电池的负极 | B. | Zn极上发生氧化反应 | ||
| C. | 电流由锌极流向碳极 | D. | H2在Zn片上生成 |
分析 该装置是原电池,根据电池反应式知,放电时,Zn元素化合价由0价变为+2价、H元素化合价由+1价变为0价,所以Zn是负极、C是正极,负极反应式为Zn-2e-=Zn2+,正极反应式为2NH4++2e-=2NH3↑+H2↑,以此解答该题.
解答 解:A.放电时,Zn元素化合价由0价变为+2价、H元素化合价由+1价变为0价,所以Zn是负极、C是正极,故A错误;
B.Zn电极上失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,故B正确;
C.锌为负极,电流由碳极流向锌极,故C错误;
D.Zn是负极、C是正极,正极反应式为2NH4++2e-=2NH3↑+H2↑,负极反应式为Zn-2e-=Zn2+,氢气在正极生成,故D错误.
故选B.
点评 本题考查化学电源新型电池,明确正负极与得失电子关系是解本题关键,知道各个电极上发生的反应及反应类型,难点是正极反应式的书写,题目难度不大.

练习册系列答案
相关题目
7.鉴别MgSO4、Al2(SO4)3、Fe2(SO4)3、(NH4)2SO4四种溶液,最好选择下列试剂中的( )
| A. | KSCN溶液 | B. | NaOH溶液 | C. | 氨水 | D. | 石蕊试液 |
6.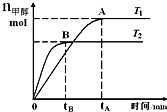 在恒容密闭的容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
在恒容密闭的容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
 在恒容密闭的容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
在恒容密闭的容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )| A. | 处于A点的反应体系从T1变到T2,达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大 | |
| B. | CO合成甲醇的反应为吸热反应 | |
| C. | 该反应在T1时的平衡常数比T2时的小 | |
| D. | 该反应平衡常数可表示为K=$\frac{c(C{H}_{3}OH)}{c(CO)c({H}_{2})}$ |
10.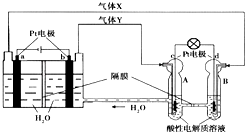 空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )
 空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池.如图为RFC工作原理示意图,有关说法正确的是( )| A. | 当有0.1mol电子转移时,a极产生1.12L O2(标况) | |
| B. | b极上发生的电极反应是:2H++2e-═H2↑ | |
| C. | d极上发生的电极反应是:O2+4H++4e-═2H2O | |
| D. | c极上进行还原反应,B中的H+可以通过隔膜进入A |
20.下列关于CO2和SO2气体的说法不正确的是( )
| A. | 与足量的澄清石灰水反应的现象不同 | |
| B. | 通入BaCl 2溶液时现象相同 | |
| C. | 通入Ba(NO3)₂溶液时现象相同 | |
| D. | 通入石蕊溶液时现象相同 |
7.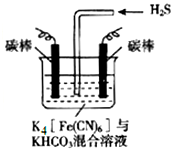 [Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )
[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )
 [Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )
[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )| A. | 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3 | |
| B. | 电解时阴极反应式为:2HCO3-+2 e-═H2↑+2CO32- | |
| C. | 当电解过程中有22.4L标准状况下的H2生成时,溶液中有32gS析出(溶解忽略不计) | |
| D. | 电解时阳极反应式为[Fe(CN)6]4--e-═[Fe(CN)6]3- |
4.下列选项描述的过程能实现化学能转化为电能的是( )
| A. |  电解冶炼铝 | B. |  电动车行驶中 | C. |  火箭升天 | D. |  风力发电 |
5.下列关于碳酸钠,碳酸氢钠性质比较错误的是( )
| A. | 热稳定性NaHCO3<Na2CO3 | B. | 常温时水中溶解度NaHCO3>Na2CO3: | ||
| C. | 与盐酸反应的速率:NaHCO3>Na2CO3 | D. | 相对分子质量:NaHCO3<Na2CO3 |