题目内容
8.有机化工原料1,4-二苯基-1,3-丁二烯及某抗结肠炎药物有效成分的合成路线如图(部分反应略去试剂和条件):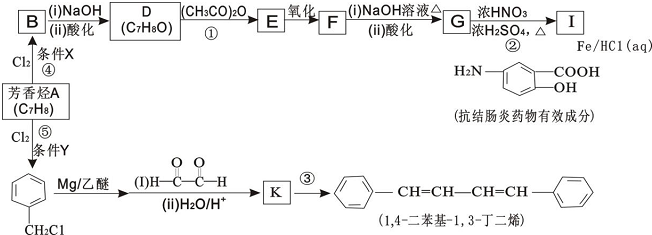
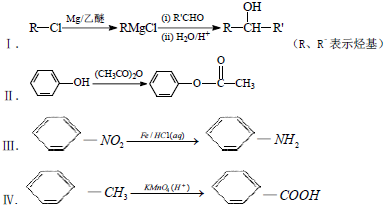
已知:
(1)抗结肠炎药物有效成分分子中的含氧官能团名称是羧基、羟基.
(2)D 的结构简式是

(3)写出F 与NaOH 反应的化学方程式
 .
.(4)下列说法正确的是BD(填选项字母).
A.④的反应条件X 和⑤的反应条件Y 完全相同
B.①②④⑤反应类型相同
C.G 不可以发生缩聚反应
D.设计D→E 和F→G 两步反应的目的是防止酚羟基被氧化
(5)③的化学方程式是
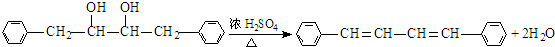 .
.(6)E 有多种同分异构体,符合下列条件的同分异构体有9种
①结构中有苯环 ②与E 有相同的官能团 ③不能发生银镜反应
(7)1,4-二苯基-1,3-丁二烯有多种同分异构体,写出符合下列条件的同分异构体的结构简式:
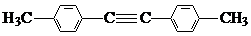 ,
,a.结构中有两个苯环,无其它环状结构
b.苯环上的一硝基取代产物有两种
c.其核磁共振氢谱有3 种峰,峰面积之比为3:2:2.
分析 芳香烃A(C7H8)为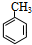 ,与氯气在光照条件下发生取代反应生成
,与氯气在光照条件下发生取代反应生成 ,
, 发生信息Ⅰ中反应生成K为
发生信息Ⅰ中反应生成K为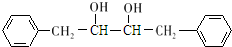 ;由
;由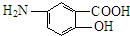 逆推可知I为
逆推可知I为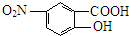 ,G为
,G为 ,D发生信息Ⅱ中的反应得到E,E氧化得到F,F酸化得到G,D→E的转化目的防止酚羟基被氧化,则E为
,D发生信息Ⅱ中的反应得到E,E氧化得到F,F酸化得到G,D→E的转化目的防止酚羟基被氧化,则E为 ,F为
,F为 ,则D为
,则D为 ,B为
,B为 ,据此解答.
,据此解答.
解答 解:芳香烃A(C7H8)为 ,与氯气在光照条件下发生取代反应生成
,与氯气在光照条件下发生取代反应生成 ,
, 发生信息Ⅰ中反应生成K为
发生信息Ⅰ中反应生成K为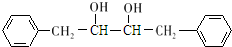 ;由
;由 逆推可知I为
逆推可知I为 ,G为
,G为 ,D发生信息Ⅱ中的反应得到E,E氧化得到F,F酸化得到G,D→E的转化目的防止酚羟基被氧化,则E为
,D发生信息Ⅱ中的反应得到E,E氧化得到F,F酸化得到G,D→E的转化目的防止酚羟基被氧化,则E为 ,F为
,F为 ,则D为
,则D为 ,B为
,B为 .
.
(1)抗结肠炎药物有效成分分子中的含氧官能团名称是:羧基、羟基,故答案为:羧基、羟基;
(2)D的结构简式是 ,故答案为:
,故答案为: ;
;
(3)F与NaOH反应的化学方程式: ,
,
故答案为: ;
;
(4)A.④的反应条件为催化剂,⑤的反应条件为光照,故A错误;
B.①②④⑤均属于取代反应,故B正确;
C.G为 ,含有羧基、羟基,可以发生缩聚反应,故C错误;
,含有羧基、羟基,可以发生缩聚反应,故C错误;
D.设计D→E和F→G两步反应的目的是防止酚羟基被氧化,故D正确,
故选:BD;
(5)反应③的化学方程式是: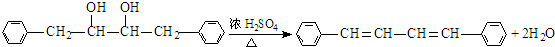 ,
,
故答案为: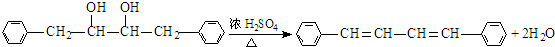 ;
;
(6)E为 ,其同分异构体符合:①结构中有苯环,②与E有相同的官能团,含有酯基,③不能发生银镜反应,不含甲酸形成的酯基,
,其同分异构体符合:①结构中有苯环,②与E有相同的官能团,含有酯基,③不能发生银镜反应,不含甲酸形成的酯基,
若只有1个取代基,为-OOCCH2CH3,或者-COOCH2CH3,或者-CH2OOCCH3,或者-CH2COOCH3,有4种,
若有2个取代基,为-CH3、-OOCH2CH3,或-CH3、-COOCH3,各有邻、间、对3种(包含E),不含E有5种,
故符合条件的同分异构体共有9种,
故答案为:9;
(7)1,4-二苯基-1,3-丁二烯有多种同分异构体中,符合下列条件:a.结构中有两个苯环,无其它环状结构,b.苯环上的一硝基取代产物有两种,c.其核磁共振氢谱有3种峰,峰面积之比为3:2:2,符合条件的同分异构体为: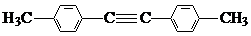
故答案为: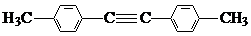
点评 本题考查有机物推断,需要学生对给予的信息进行利用,能较好的考查学生自学能力,需要学生熟练掌握官能团性质与转化,结合转化关系中有机物的结构利用逆推法进行推断,对学生的推理有一定的要求,(6)中同分异构体数目判断为易错点,难度中等.

| A. | 四氯化碳分子的比例模型: | |
| B. | CH3CH2NO2与H2NCH2COOH互为同分异构体 | |
| C. | 氯乙烷结构简式:CH2ClCH2Cl | |
| D. | 丙烯的键线式: |
| A. |  | B. | 26M3+ | C. |  | D. | CH3COONa |
(1)I-、ClO-、NO3-、H+
(2)k+、Ag(NH3)2+、NO3-、H+
(3)NH4+、SO42-、Cl-、HCO3-
(4)Fe3+、Cu2+、SO42-、Cl-
(5)H+、k+、AlO2-、C6H15O-
(6)Pb2+、Na+、SO42-、NO3-.
| A. | (1)和(6) | B. | (3)和(4) | C. | (2)和(4) | D. | (2)和(5) |
| A. | 苯的最简式 C6H6 | B. | 乙醇的分子式C2H6O | ||
| C. | 乙烯的结构简式CH2CH2 | D. | NH4Cl的电子式 |
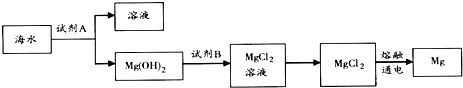
①工业上冶炼镁的方法有两种,电解法和皮江法.电解法是电解熔融的氯化镁;皮江法是硅在高温下还原氧化镁.
②霍尔-埃鲁铝电解法是以氧化铝为原料、冰晶石(Na3AlF6)为熔剂组成的电解质,在950-970℃的条件下通过电解的方法使电解质熔体中的氧化铝分解为铝和氧气.
③湿法炼铜是工业上常用的一种炼铜的方法.使用铁和硫酸铜溶液反应.
④工业上冶炼银的方法是加热条件下让氧化银分解.
⑤冶炼锰一般用铝热法,即在高温下用铝还原二氧化锰.
⑥相关各物质熔点见如表
| 物质 | Al2O3 | AlCl3 | MgO | MgCl2 | Al | Mn | Mg |
| 熔点/℃ | 2303 | 190 | 2800 | 712 | 660 | 1244 | 649 |
(1)影响金属冶炼方法的首要因素是金属的活泼性.
(2)冶炼镁时电解熔融MgCl2而不电解熔融MgO,冶炼铝时电解熔融Al2O3而不电解熔融AlCl3的原因是MgO的熔点比MgCl2的熔点高,MgO熔融时耗费更多能源,增加成本;AlCl3属于共价化合物,熔融状态下不导电,故不能电解AlCl3.
(3)写出铝热法冶炼锰的化学方程式4Al+3MnO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3Mn,一般使用铝热法冶炼的金属具有哪些性质熔点高且比铝不活泼的金属.
Ⅱ如面是皮江法冶炼镁的工业流程示意图

(1)气体a是CO2.
(2)白云石煅烧前粉碎的目的是增大固体表面积,提高反应速率.
(3)还原炉需控制温度为1200℃左右,并抽空气到近似真空,还原炉中发生的主要反应有2MgO+Si$\frac{\underline{\;高温\;}}{\;}$2Mg↑+SiO2、SiO2+CaO$\frac{\underline{\;高温\;}}{\;}$CaSiO3.
(4)还原炉中抽空气到近似真空的原因是防止已还原的Mg在高温条件下再次被氧化.
| A. | 2:1 | B. | 2:3 | C. | 4:3 | D. | 1:1 |
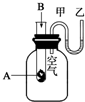 为了研究化学反应A+B═C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题:
为了研究化学反应A+B═C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题: