题目内容
18.质量比为2:1的H2SO4和H3PO4,它们所含氢原子物质的量之比是( )| A. | 2:1 | B. | 2:3 | C. | 4:3 | D. | 1:1 |
分析 H2SO4与H3PO4的摩尔质量都是98g/mol,质量之比等于物质的量之比,再结合物质的分子式构成来分析.
解答 解:H2SO4与H3PO4的摩尔质量都是98g/mol,质量比为2:1的H2SO4和H3PO4其物质的量之比为2:1,
1个H2SO4中有2个H,1个H3PO4中有3个H,所以氢原子数之比为(2×2):(1×3)=4:3,
故选C.
点评 本题考查物质的量的有关计算,题目难度不大,熟悉物质的摩尔质量,质量与物质的量的关系、物质的构成即可解答,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
6.含铬工业废水的一种处理流程如下:
CrO42-$\underset{\stackrel{{H}^{+}}{→}}{①转化}$Cr2O72-$\underset{\stackrel{F{e}^{2+}}{→}}{②还原}$Cr3+
不能说明转化一步反应达平衡状态的是( )
CrO42-$\underset{\stackrel{{H}^{+}}{→}}{①转化}$Cr2O72-$\underset{\stackrel{F{e}^{2+}}{→}}{②还原}$Cr3+
不能说明转化一步反应达平衡状态的是( )
| A. | Cr2O72-和CrO42-的浓度相同 | B. | 2v正(Cr2O72-)=v逆(CrO42-) | ||
| C. | 溶液的颜色不变 | D. | 溶液的pH不变 |
13.为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位同学分别设计了如下四个实验,你认为结论正确的是( )
| A. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,可看到有氢气生成 | |
| B. | 将除去氧化膜的相同大小、相同质量的镁条和铝条与相同浓度NaOH溶液反应,前者速率大于后者 | |
| C. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 | |
| D. | 大理石和盐酸反应制取CO2,增加大理石的用量可加快反应速率 |
3.下列非金属元素所形成的氢化物最稳定的是( )
| A. | F | B. | Cl | C. | Br | D. | I |
10.NA代表阿伏伽德罗常数,下列关于电子转移的说法正确的是( )
| A. | 5.6g Fe参与反应转移的电子数一定为0.2NA | |
| B. | 2.3g Na参与反应转移的电子数一定为0.1NA | |
| C. | 标况下,2.24L Cl2参与反应转移的电子数一定为0.2NA | |
| D. | 标况下,2.24L O2参与反应转移的电子数一定为0.4NA |
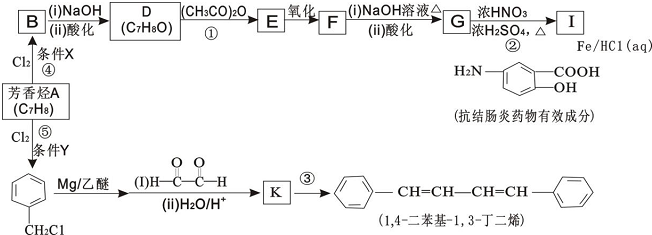

 .
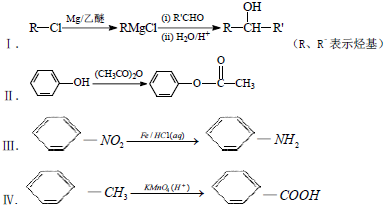
.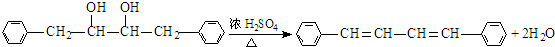 .
.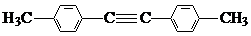 ,
,
 .
.


