题目内容
16.下列粒子中,对H2O的电离平衡不产生影响的是( )| A. |  | B. | 26M3+ | C. |  | D. | CH3COONa |
分析 水的电离方程式为H2O═H++OH-,加入酸或碱能抑制水的电离,加入含有弱根离子的盐能促进水的电离,强酸强碱盐不影响水的电离,以此解答该题.
解答 解:A.氯化氢溶于水后能电离出氢离子,使水的电离向左移动,所以能抑制水的电离,故A不选;
B.26M3+为26Fe3+,Fe3+能结合水电离的氢氧根离子生成弱电解质,使水的电离向正移,所以促进水的电离,故B不选;
C. 为Cl-,加入Cl-后,对水的电离平衡没有影响,平衡不移动,故C选;
为Cl-,加入Cl-后,对水的电离平衡没有影响,平衡不移动,故C选;
D.加入了CH3COO-,CH3COO- 会结合H+,c(H+)减小,平衡向右移动,故D不选.
故选C.
点评 本题考查了水的电离,影响水的电离的因素有:温度、酸碱、含有弱根离子的盐,酸或碱能抑制水的电离,含有弱根离子的盐能促进水的电离,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.闪电时空气中有臭氧生成.下列说法正确的是( )
| A. | O3和O2互为同位素 | |
| B. | O3与O2的相互转变是物理变化 | |
| C. | 相同状况下,等体积O3和O2含有相同质子数 | |
| D. | O3比O2氧化性更强 |
4.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示其中Y所处的周期序数与族序数相等.按要求回答下列问题:
(1)写出X的原子结构示意图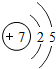 .
.
(2)列举一个事实说明X非金属性强于Z:2HNO3+Na2SiO3=2NaNO3+H2SiO3↓;(用化学方程式表示)
(3)含Y的氯化物呈酸性的原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示)
| X | ||||
| Y | Z | W |
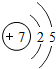 .
.(2)列举一个事实说明X非金属性强于Z:2HNO3+Na2SiO3=2NaNO3+H2SiO3↓;(用化学方程式表示)
(3)含Y的氯化物呈酸性的原因是Al3++3H2O?Al(OH)3+3H+(用离子方程式表示)
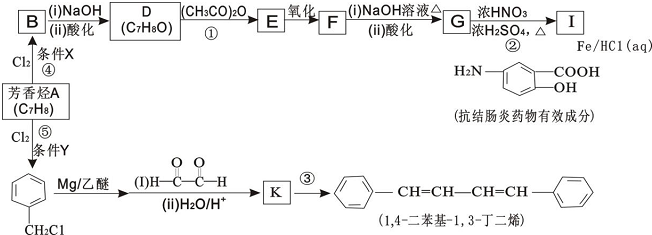
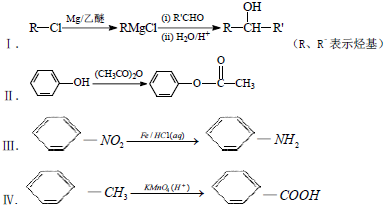
1.表是A、B、C、D、E五种有机物的有关信息.
(1)A~E中,属于烃的是AB(填字母).
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
(3)C催化氧化生成D的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(4)有机物B具有的性质是②③ (填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是2CH3COOH+CaCO3=(CH3COO)2Ca+CO2↑+H2O(用化学方程式说明).
| A | ①能使溴的四氯化碳溶液褪色 ②比例模型为 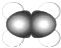 ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成 ②球棍模型为 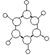 |
| C | ①由C、H、O三种元素组成 ②能与Na反应 ③与E反应生成相对分子质量为88的酯 |
| D | ①相对分子质量比C少2 ②能由C催化氧化得到 |
| E | ①由C、H、O三种元素组成 ②其水溶液能使紫色石蕊试液变红 |
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.
(3)C催化氧化生成D的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(4)有机物B具有的性质是②③ (填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是2CH3COOH+CaCO3=(CH3COO)2Ca+CO2↑+H2O(用化学方程式说明).
6.含铬工业废水的一种处理流程如下:
CrO42-$\underset{\stackrel{{H}^{+}}{→}}{①转化}$Cr2O72-$\underset{\stackrel{F{e}^{2+}}{→}}{②还原}$Cr3+
不能说明转化一步反应达平衡状态的是( )
CrO42-$\underset{\stackrel{{H}^{+}}{→}}{①转化}$Cr2O72-$\underset{\stackrel{F{e}^{2+}}{→}}{②还原}$Cr3+
不能说明转化一步反应达平衡状态的是( )
| A. | Cr2O72-和CrO42-的浓度相同 | B. | 2v正(Cr2O72-)=v逆(CrO42-) | ||
| C. | 溶液的颜色不变 | D. | 溶液的pH不变 |


 .
.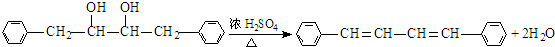 .
.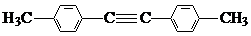 ,
,
