题目内容
3.下列各组离子,在水溶液中能大量共存的是( )(1)I-、ClO-、NO3-、H+
(2)k+、Ag(NH3)2+、NO3-、H+
(3)NH4+、SO42-、Cl-、HCO3-
(4)Fe3+、Cu2+、SO42-、Cl-
(5)H+、k+、AlO2-、C6H15O-
(6)Pb2+、Na+、SO42-、NO3-.
| A. | (1)和(6) | B. | (3)和(4) | C. | (2)和(4) | D. | (2)和(5) |
分析 (1)离子之间发生氧化还原反应;
(2)酸性条件下Ag(NH3)2+不能大量共存;
(3)离子之间不发生任何反应;
(4)离子之间不发生任何反应;
(5)酸性条件下弱酸的酸根离子不能大量共存;
(6)反应生成沉淀.
解答 解:(1)酸性条件下ClO-、NO3-具有强氧化性,与I-发生氧化还原反应,故错误;
(2)酸性条件下Ag(NH3)2+不能大量共存,故错误;
(3)离子之间不发生任何反应,可大量共存,故正确;
(4)离子之间不发生任何反应,可大量共存,故正确;
(5)酸性条件下弱酸的AlO2-、C6H15O-不能大量共存,故错误;
(6)Pb2+、SO42-反应生成沉淀,不能大量共存,故错误.
故选B.
点评 本题考查离子共存的正误判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
14.I.在实验室利用如图装置,可制备某些气体并验证其化学性质.

完成下列表格:
II.工业上用乙烯、氯化氢和氯气为原料,经下列各步合成聚氯乙烯(PVC):
乙烯$→_{①}^{一定条件}$A$→_{②}^{NaOH/乙醇}$B$→_{③}^{一定条件}$C$→_{④}^{一定条件}$PVC
A的结构简式是CH2ClCH2Cl;
反应④的化学方程式是 .
.

完成下列表格:
| 序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
| (1) | 乙烯 | B→D→E | CH3-CH2-OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O |
| (2) | 乙炔 | A→C→E | CaC2+2H2O→Ca(OH)2+C2H2↑ |
乙烯$→_{①}^{一定条件}$A$→_{②}^{NaOH/乙醇}$B$→_{③}^{一定条件}$C$→_{④}^{一定条件}$PVC
A的结构简式是CH2ClCH2Cl;
反应④的化学方程式是
 .
.
18.除去下列物质中杂质(括号中为杂质)的方法不合理的是( )
| A. | CO2(HCl):碳酸钠溶液 | B. | Cl2(HCl):通过饱和食盐水 | ||
| C. | Na2CO3(NaHCO3):加热固体 | D. | N2(O2):灼热的铜网 |
15.为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如表,t表示收集a mL O2所需的时间:
(1)设计实验2和实验3的目的是研究H2O2的浓度对化学反应速率的影响;
(2)为研究温度对化学反应速率的影响,可以将实验2和实验4作对比(填序号);
(3)将实验1和实验2作对比,t1>t2(填“>”、“<”或“=”).
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-?2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:
①0.1mol•L-1KI溶液②0.1mol•L-1 FeCl3溶液③0.1mol•L-1 FeCl2溶液
④0.1mol•L-1盐酸⑤0.1mol•L-1KSCN溶液⑥CCl4
实验步骤:
(1)取5mL 0.1mol•L-1 KI溶液,再滴加几滴0.1mol•L-1 FeCl3溶液;
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂⑤(填序号),溶液出现血红色现象,说明此反应存在一定的限度.
Ⅲ.N2O4可分解为NO2.在100mL密闭容器中投入0.01mol N2O4,利用现代化学实验技术跟踪测量c(NO2).c(NO2)随时间变化的数据记录如图所示:
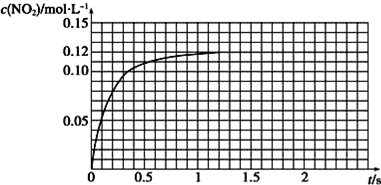
(1)反应容器中最后剩余的物质有NO2、N2O4,其中N2O4的物质的量为0.004molmol;
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,最后不变.(选填“变大”,“变小”或“不变”)
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如表,t表示收集a mL O2所需的时间:
| 序号 | 反应 温度/℃ | c(H2O2)/ mol•L-1 | V(H2O2) /mL | m(MnO2) /g | t/min |
| 1 | 20 | 2 | 10 | 0 | t1 |
| 2 | 20 | 2 | 10 | 0.1 | t2 |
| 3 | 20 | 4 | 10 | 0.1 | t3 |
| 4 | 40 | 2 | 10 | 0.1 | t4 |
(2)为研究温度对化学反应速率的影响,可以将实验2和实验4作对比(填序号);
(3)将实验1和实验2作对比,t1>t2(填“>”、“<”或“=”).
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-?2Fe2++I2)设计实验,探究此反应存在一定的限度.可选试剂:
①0.1mol•L-1KI溶液②0.1mol•L-1 FeCl3溶液③0.1mol•L-1 FeCl2溶液
④0.1mol•L-1盐酸⑤0.1mol•L-1KSCN溶液⑥CCl4
实验步骤:
(1)取5mL 0.1mol•L-1 KI溶液,再滴加几滴0.1mol•L-1 FeCl3溶液;
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂⑤(填序号),溶液出现血红色现象,说明此反应存在一定的限度.
Ⅲ.N2O4可分解为NO2.在100mL密闭容器中投入0.01mol N2O4,利用现代化学实验技术跟踪测量c(NO2).c(NO2)随时间变化的数据记录如图所示:

(1)反应容器中最后剩余的物质有NO2、N2O4,其中N2O4的物质的量为0.004molmol;
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,最后不变.(选填“变大”,“变小”或“不变”)
13.为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位同学分别设计了如下四个实验,你认为结论正确的是( )
| A. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,可看到有氢气生成 | |
| B. | 将除去氧化膜的相同大小、相同质量的镁条和铝条与相同浓度NaOH溶液反应,前者速率大于后者 | |
| C. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 | |
| D. | 大理石和盐酸反应制取CO2,增加大理石的用量可加快反应速率 |
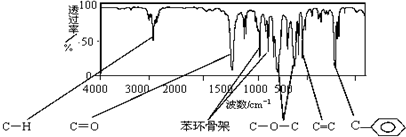
 .
.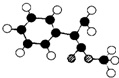 (图中球与球之间连线表示单键或双键).
(图中球与球之间连线表示单键或双键).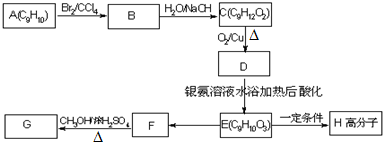
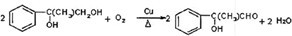 .E→H
.E→H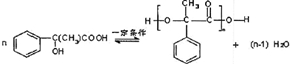 .
.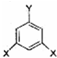 (其中X、Y均不为H),试写出符合上述通式且能发生银镜反应和遇氯化铁溶液发生显色反应的2种物质的结构简式
(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应和遇氯化铁溶液发生显色反应的2种物质的结构简式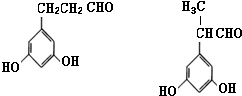 .
.

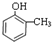
 .
.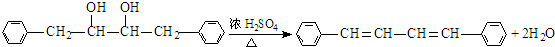 .
.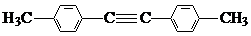 ,
,