题目内容
18.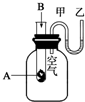 为了研究化学反应A+B═C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题:
为了研究化学反应A+B═C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题:(1)该反应为放热反应(填“放热”或“吸热”).
(2)A和B的总能量比C和D的总能量高(填“高”或“低”).
(3)物质中的化学能通过化学反应转化成热能释放出来.
(4)反应物化学键断裂吸收的能量低(填“高”或“低”)于生成物化学键形成放出的能量.
(5)若甲烷的燃烧热为890kJ/mol,请写出表示甲烷燃烧热的热化学方程式CH4(g)+2O2(g)=CO2(g)+H2O(l)△H=-890kJ•mol-1.
分析 当向盛有A的试管中滴加试剂B时,看到U型管中甲处液面下降乙处液面上升,根据气体具有热胀冷缩的性质,可以判断反应的吸放热情况,根据反应物和生成物能量之间的关系与反应的吸放热之间的关系以及化学键断裂和生成过程的能量变化进行回答,
(1)根据气体具有热胀冷缩的性质可以判断该反应为放热反应;
(2)反应为吸热反应,反应物能量低于生成物;
(3)化学变化伴随着物质和能量变化,主要是热量;
(4)化学反应中旧键断裂吸收能量,新键生成放出能量;
(5)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,据此书写燃烧热的热化学方程式;
解答 解:(1)由于发生反应A+B═C+D,U型管中甲处液面下降乙处液面上升,根据气体具有热胀冷缩的性质可以判断该反应为放热反应,
故答案为:放热;
(2)由于A+B═C+D的反应为吸热反应,所以A和B的总能量比C和D的总能量高,
故答案为:高;
(3)化学变化伴随着物质和能量变化,物质中的化学能通过化学反应转化成热能释放出来,
故答案为:化学反应;热能;
(4)化学反应中旧键断裂吸收能量,新键生成放出能量,该反应为吸热反应,则反应物化学键断裂吸收的能量低于生成物化学键形成放出的能量,
故答案为:低.
(5)CH4(g)的燃烧热为△H=-890kJ/mol,则甲烷的燃烧热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+H2O(l)△H=-890kJ•mol-1 ;
点评 本题考查了化学反应中的吸热反应与放热反应,题目难度不大,注意掌握化学反应中能量变化与反应物、生成物总能量的关系,明确化学键断裂、形成与化学反应能量变化的关系.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
8.下列变化属于加成反应的是( )
| A. | 乙烯通入酸性高锰酸钾溶液中 | B. | 乙烯通入溴水中 | ||
| C. | 苯与液溴在FeBr3催化下反应 | D. | 甲烷与氯气在一定条件下反应 |
9.如图粒子的结构示意图中,表示氯离子的是( )
| A. |  | B. |  | C. |  | D. |  |
10.乙醇和二甲醚互为同分异构体,下列说法不正确的是( )
| A. | 乙醇和二甲醚的分子式相同,结构不同 | |
| B. | 乙醇和二甲醚的物理性质不同,化学性质相同 | |
| C. | 二者完全燃烧后的产物相同 | |
| D. | 1mol二甲醚分子中含有8NA共价键 |
7.闪电时空气中有臭氧生成.下列说法正确的是( )
| A. | O3和O2互为同位素 | |
| B. | O3与O2的相互转变是物理变化 | |
| C. | 相同状况下,等体积O3和O2含有相同质子数 | |
| D. | O3比O2氧化性更强 |


 .
. (图中球与球之间连线表示单键或双键).
(图中球与球之间连线表示单键或双键).
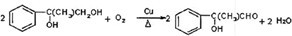 .E→H
.E→H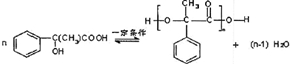 .
. (其中X、Y均不为H),试写出符合上述通式且能发生银镜反应和遇氯化铁溶液发生显色反应的2种物质的结构简式
(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应和遇氯化铁溶液发生显色反应的2种物质的结构简式 .
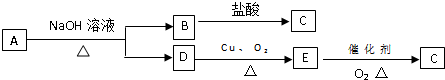
.
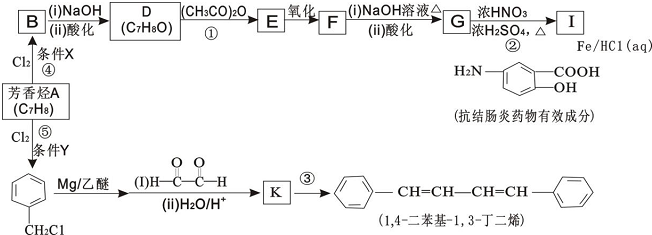
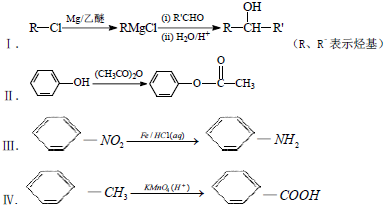

 .
.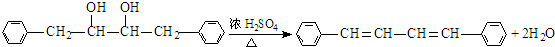 .
.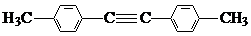 ,
,