题目内容
2SO2(g)+O2(g)?2SO3(g)是工业制硫酸的主要反应之一.一定温度下,在甲、乙、丙、丁四个容积为2L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如表所示.下列判断中,正确的是( )
| 甲 | 乙 | 丙 | 丁 | ||
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.40 | 0.80 | 0 |
| n(O2)/mol | 0.24 | 0.48 | 0.48 | 0.04 | |
| n(SO3)/mol | 0 | 0 | 0 | 0.40 | |
| 含硫反应物的平衡转化率/% | 80 | α1 | α2 | α3 | |
| A、丁中SO3的平衡转化率为α3=80% |
| B、该温度下,平衡常数的值为400 |
| C、平衡时,丙中c(SO3)是甲中的2倍 |
| D、平衡时,甲中O2的转化率小于乙中O2的转化率 |
考点:化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:A、丁的投料总物质的量小于甲的投料,根据平衡移动的影响来回答;
B、根据平衡常数只受温度的影响来回答;
C、丙的投料是甲的2倍,加压,平衡会正向移动;
D、由甲、乙可知,二氧化硫的浓度相同,增加氧气的投料,氧气的转化率会减小.
B、根据平衡常数只受温度的影响来回答;
C、丙的投料是甲的2倍,加压,平衡会正向移动;
D、由甲、乙可知,二氧化硫的浓度相同,增加氧气的投料,氧气的转化率会减小.
解答:
解:A、丁的投料总物质的量小于甲的投料,相当于在甲的基础上加压,平衡正向移动,所以丁中SO3的平衡转化率为α3<80%,故A错误;
B、根据甲容器条件下达到平衡时,2SO2(g)+O2(g)?2SO3(g)
初始浓度:0.2 0.12 0
变化浓度:0.16 0.08 0.16
平衡浓度:0.04 0.04 0.16
此时K=
=400,即平衡常数的值为400,故B正确;
C、丙的投料是甲的2倍,但是相当于在甲的基础上加压,加压,平衡会正向移动平衡时,所以丙中c(SO3)是甲中的2倍还要多,故C错误;
D、由甲、乙可知,二氧化硫的浓度相同,增加氧气的投料,氧气的转化率会减小,甲中O2的转化率大于乙中O2的转化率,故D错误;
故选B.
B、根据甲容器条件下达到平衡时,2SO2(g)+O2(g)?2SO3(g)
初始浓度:0.2 0.12 0
变化浓度:0.16 0.08 0.16
平衡浓度:0.04 0.04 0.16
此时K=
| 0.162 |
| 0.042×0.04 |
C、丙的投料是甲的2倍,但是相当于在甲的基础上加压,加压,平衡会正向移动平衡时,所以丙中c(SO3)是甲中的2倍还要多,故C错误;
D、由甲、乙可知,二氧化硫的浓度相同,增加氧气的投料,氧气的转化率会减小,甲中O2的转化率大于乙中O2的转化率,故D错误;
故选B.
点评:本题考查转化率、平衡移动、化学反应速率,注意增加反应物的量时,平衡转化率的改变,题目难度中等.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
下列溶液能跟铜片反应,而且铜片的质量会减轻的是( )
| A、盐酸 |
| B、FeCl3溶液 |
| C、AgNO3溶液 |
| D、NaCl溶液 |
若NA表示阿伏加德罗常数的数值,下列叙述中不正确的是( )
| A、16g O2与O3混合物中所含电子数为8NA |
| B、标准状况下,2.24LCH3OH分子中共用电子对数为0.5NA |
| C、6gSiO2晶体中硅氧共价键数为0.4NA |
| D、0.1mol13C18O中所含中子数为1.7NA |
下列金属中,不能从硫酸铜溶液里置换出铜的是( )
| A、Al | B、Zn | C、Fe | D、Na |
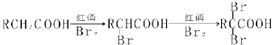
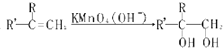

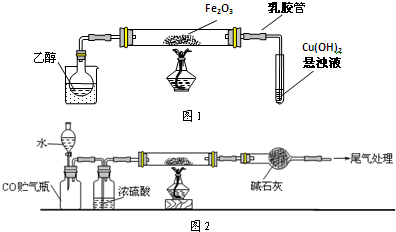
 Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.
Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.