题目内容
下列溶液能跟铜片反应,而且铜片的质量会减轻的是( )
| A、盐酸 |
| B、FeCl3溶液 |
| C、AgNO3溶液 |
| D、NaCl溶液 |
考点:铜金属及其重要化合物的主要性质
专题:元素及其化合物
分析:铜片的质量会减轻,则Cu溶解,与具有氧化性的物质发生氧化还原反应,若发生金属单质之间的置换反应,应置换出相对分子质量比Cu小的金属,以此来解答.
解答:
解:A.Cu的活泼性较弱,Cu与盐酸不反应,故A不选;
B.发生Cu+2FeCl3=2FeCl2+CuCl2,Cu溶解则其质量会减轻,故B选;
C.Cu与硝酸银发生置换反应生成Ag,固体质量会增加,故C不选;
D.Cu与NaCl溶液不能发生反应,则Cu的质量不变,故D不选;
故选B.
B.发生Cu+2FeCl3=2FeCl2+CuCl2,Cu溶解则其质量会减轻,故B选;
C.Cu与硝酸银发生置换反应生成Ag,固体质量会增加,故C不选;
D.Cu与NaCl溶液不能发生反应,则Cu的质量不变,故D不选;
故选B.
点评:本题考查金属及其化合物的性质,为高频考点,把握发生的氧化还原反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
如果将质量相同的铜片在酒精灯上加热后,趁热加入下列物质中,放置片刻,Cu片质量与原来相比减小的是( )
| A、盐酸 |
| B、CO |
| C、NaOH |
| D、C2H5OH |
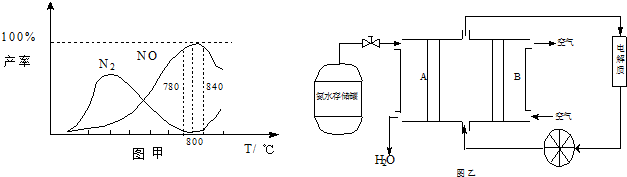
2SO2(g)+O2(g)?2SO3(g)是工业制硫酸的主要反应之一.一定温度下,在甲、乙、丙、丁四个容积为2L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如表所示.下列判断中,正确的是( )
| 甲 | 乙 | 丙 | 丁 | ||
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.40 | 0.80 | 0 |
| n(O2)/mol | 0.24 | 0.48 | 0.48 | 0.04 | |
| n(SO3)/mol | 0 | 0 | 0 | 0.40 | |
| 含硫反应物的平衡转化率/% | 80 | α1 | α2 | α3 | |
| A、丁中SO3的平衡转化率为α3=80% |
| B、该温度下,平衡常数的值为400 |
| C、平衡时,丙中c(SO3)是甲中的2倍 |
| D、平衡时,甲中O2的转化率小于乙中O2的转化率 |
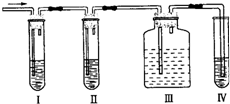 某混合气体可能是乙烯和二氧化硫的混合气,有人设计下列实验图以确认上述混合气体中有CH2=CH2和SO2.Ⅰ、Ⅱ、Ⅲ、Ⅳ装置中盛放的试剂依次是:品红溶液、NaOH溶液、品红溶液、酸性KMnO4溶液.回答下列问题:
某混合气体可能是乙烯和二氧化硫的混合气,有人设计下列实验图以确认上述混合气体中有CH2=CH2和SO2.Ⅰ、Ⅱ、Ⅲ、Ⅳ装置中盛放的试剂依次是:品红溶液、NaOH溶液、品红溶液、酸性KMnO4溶液.回答下列问题: