题目内容
 Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.
Na2O2是中学化学常用的强氧化剂,除了能与CO2、H2O反应外,还可与其他还原剂如H2、C发生反应,某化学课外兴趣小组为探究Na2O2与H2的反应情况,设计了如图所示装置进行有关实验.(1)实验前,装置的气密性检验方法是
(2)该装置中,碱石灰的作用是
(3)在启普发生器中,下列做法可以加快生成氢气速率的有
A.滴加少量的硫酸铜溶液B.铁粒改用相同量的铁粉C.稀盐酸改为浓度为其2倍的稀硝酸D.适当加热
(4)若实验过程中观察到淡黄色粉末变成白色,干燥管内硫酸铜变成蓝色.则Na2O2与H2反应的化学方程式为
(5)实际实验过程中观察到Na2O2熔化后,很快变成白色粉末,但干燥管内硫酸铜并未变成蓝色.则Na2O2与H2反应的化学方程式为
(6)出于实验安全考虑,实验结束时
A.应先关闭活塞b,然后移去酒精灯
B.应先移去酒精灯,然后关闭活塞b
C.A和B都可以.
考点:碱金属及其化合物的性质实验
专题:实验题
分析:(1)将干燥管上口堵住、打开b,然后从启普发生器上口加水至上下液面存在一段明显的高度差,根据液面差是否变化判断装置的气密性;
(2)碱石灰能够吸收水分和氯化氢;根据氢气纯度不足容易发生爆炸进行解答;
(3)启普发生器不能加热、反应物必须有一种为固体、硝酸与金属不会生成氢气、铜与铁能够形成原电池,据此进行解答;
(4)干燥管内硫酸铜变成蓝色,反应生成了水,说明过氧化钠与氢气反应生成氧化钠和水;
(5)很快变成白色粉末,但干燥管内硫酸铜并未变成蓝色,说明反应产物中没有水,据此写出反应的化学方程式;
(6)如果先关闭b,装置中会进入空气,导致氢气纯度不足,可能发生爆炸.
(2)碱石灰能够吸收水分和氯化氢;根据氢气纯度不足容易发生爆炸进行解答;
(3)启普发生器不能加热、反应物必须有一种为固体、硝酸与金属不会生成氢气、铜与铁能够形成原电池,据此进行解答;
(4)干燥管内硫酸铜变成蓝色,反应生成了水,说明过氧化钠与氢气反应生成氧化钠和水;
(5)很快变成白色粉末,但干燥管内硫酸铜并未变成蓝色,说明反应产物中没有水,据此写出反应的化学方程式;
(6)如果先关闭b,装置中会进入空气,导致氢气纯度不足,可能发生爆炸.
解答:
解:(1)实验前,装置的气密性检验方法为:将干燥管上口用橡胶头堵住(或关闭活塞a),打开b,从启普发生器上口加水至上下液面存在一段明显的高度差,一分钟内液面不下降,则气密性良好,
故答案为:将干燥管上口用橡胶头堵住(或关闭活塞a),打开b,从启普发生器上口加水至上下液面存在一段明显的高度差,一分钟内液面不下降,则气密性良好;
(2)氯化氢具有挥发性,制取的氢气中含有水和HCl,二者都干扰实验,需要用碱石灰吸收;制取的氢气容易燃烧,装置中如果含有空气,容易导致氢气纯度不足发生爆炸,所以实验开始时,先打开a、b产生氢气,一段时间后将空气完全排出,再点燃酒精灯,避免发生爆炸,
故答案为:吸收氯化氢和干燥气体;赶出装置内的空气,防止爆炸;
(3)A.滴加少量的硫酸铜溶液,铁与置换出的铜形成原电池,可以加快反应速率,故A正确;
B.启普发生器中,如果铁粒改用相同量的铁粉,则无法控制氢气的产生与停止,故B错误;
C.稀盐酸改为浓度为其2倍的稀硝酸,稀硝酸具有强氧化性,铁与硝酸反应不会生成氢气,故C错误;
D.适当加热:启普发生器不能加热,故D错误;
故答案为:A;
(4)淡黄色的过氧化钠变成了白色的氧化钠,干燥管内硫酸铜变成蓝色,说明反应生成了水,发生反应为:Na2O2+H2
Na2O+H2O,
故答案为:Na2O2+H2
Na2O+H2O;
(5)过氧化钠很快变成白色粉末,但干燥管内硫酸铜并未变成蓝色,说明反应中没有生成水,则生成产物为氢氧化钠,反应的化学方程式为:Na2O2+H2
2NaOH,
故答案为:Na2O2+H2
2NaOH;
(6)当关闭b时,装置中不再产生氢气,则空气会从干燥管进入大试管,导致氢气纯度不足,可能会发生爆炸,所以应该先撤去酒精灯,然后再关闭b,即B正确,
故答案为:B.
故答案为:将干燥管上口用橡胶头堵住(或关闭活塞a),打开b,从启普发生器上口加水至上下液面存在一段明显的高度差,一分钟内液面不下降,则气密性良好;
(2)氯化氢具有挥发性,制取的氢气中含有水和HCl,二者都干扰实验,需要用碱石灰吸收;制取的氢气容易燃烧,装置中如果含有空气,容易导致氢气纯度不足发生爆炸,所以实验开始时,先打开a、b产生氢气,一段时间后将空气完全排出,再点燃酒精灯,避免发生爆炸,
故答案为:吸收氯化氢和干燥气体;赶出装置内的空气,防止爆炸;
(3)A.滴加少量的硫酸铜溶液,铁与置换出的铜形成原电池,可以加快反应速率,故A正确;
B.启普发生器中,如果铁粒改用相同量的铁粉,则无法控制氢气的产生与停止,故B错误;
C.稀盐酸改为浓度为其2倍的稀硝酸,稀硝酸具有强氧化性,铁与硝酸反应不会生成氢气,故C错误;
D.适当加热:启普发生器不能加热,故D错误;
故答案为:A;
(4)淡黄色的过氧化钠变成了白色的氧化钠,干燥管内硫酸铜变成蓝色,说明反应生成了水,发生反应为:Na2O2+H2
| ||
故答案为:Na2O2+H2
| ||
(5)过氧化钠很快变成白色粉末,但干燥管内硫酸铜并未变成蓝色,说明反应中没有生成水,则生成产物为氢氧化钠,反应的化学方程式为:Na2O2+H2
| ||
故答案为:Na2O2+H2
| ||
(6)当关闭b时,装置中不再产生氢气,则空气会从干燥管进入大试管,导致氢气纯度不足,可能会发生爆炸,所以应该先撤去酒精灯,然后再关闭b,即B正确,
故答案为:B.
点评:本题考查了性质实验方案的设计与评价、钠的化合物性质探究,题目难度中等,注意掌握钠及其化合物性质,明确性质实验方案设计与评价方法,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
2SO2(g)+O2(g)?2SO3(g)是工业制硫酸的主要反应之一.一定温度下,在甲、乙、丙、丁四个容积为2L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如表所示.下列判断中,正确的是( )
| 甲 | 乙 | 丙 | 丁 | ||
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.40 | 0.80 | 0 |
| n(O2)/mol | 0.24 | 0.48 | 0.48 | 0.04 | |
| n(SO3)/mol | 0 | 0 | 0 | 0.40 | |
| 含硫反应物的平衡转化率/% | 80 | α1 | α2 | α3 | |
| A、丁中SO3的平衡转化率为α3=80% |
| B、该温度下,平衡常数的值为400 |
| C、平衡时,丙中c(SO3)是甲中的2倍 |
| D、平衡时,甲中O2的转化率小于乙中O2的转化率 |
下列物质能与水反应生成强酸的是( )
| A、Na2O2 |
| B、CO2 |
| C、SO3 |
| D、NH3 |
0.3mol硼烷(B2H6)在氧气中完全燃烧生成B2O3固体和液态水,放出649.5kJ热量.下列判断正确的是( )
| A、该反应是非氧化还原反应 |
| B、在理论上可以利用该反应的原理做成燃料电池 |
| C、该反应的热化学方程式为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=2 165 kJ?mol-1 |
| D、每生成18 g水,该反应转移2 mol电子 |

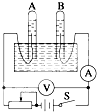 如图所示为电解水的装置,闭合开关S后,观察到电压表示数为6.0V,电流表示数为100mA.
如图所示为电解水的装置,闭合开关S后,观察到电压表示数为6.0V,电流表示数为100mA.