题目内容
12.以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)为原料,制备粗铅,实现铅的再生利用.其工作流程如1所示: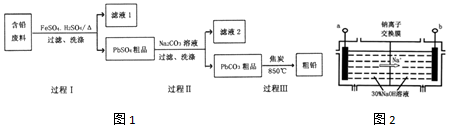
已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
(1)过程I中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是Pb+PbO2+2H2SO4$\frac{\underline{\;Fe_{2}+\;}}{\;}$2PbSO4+2H2O.
(2)过程I中,Fe2+催化过程可表示为:
i.2Fe2++PbO2+4H++SO42-═2Fe3++PbSO4+2H2O
ii.….
①写出ii的离子方程式:2Fe3++Pb+SO42-=PbSO4+2Fe2+;
②下列实验方案可证实上述催化过程.将实验方案补充完整.
| 编号 | 实验操作 | 现象 |
| 步骤1 | 向酸化的FeSO4溶液中加入KSCN溶液 | 溶液几乎无色 |
| 步骤2 | 取步骤1中反应液少量,加入少量PbO2,充分反应 | 溶液变红 |
| 步骤3 | 取步骤2中反应液少量,加入足量Pb,充分反应 | 红色褪去 |
(4)钠离子交换膜固相电解法是从含铅废料中提取铅的一种新工艺,其装置如图2所示.将含铅废料投入阴极室,含铅废料中的PbSO4与NaOH溶液发生反应:PbSO4+3OH-═HPbO2-+SO42-+H2O.
①b与外接电源的负极相连;
②电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为PbO2+4e-+2H2O=Pb+4OH-;
③与传统无膜固相电解法相比,使用钠离子交换膜可以提高Pb元素的利用率,原因是阻止HPbO2-进入阳极室被氧化.
分析 以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)为原料,制备粗铅,含铅废料加入硫酸亚铁、稀硫酸加热反应过滤得到PbSO4粗品,加入碳酸钠溶液过滤得到PbCO3粗品,向其中加入焦炭在850℃生成铅,
(1)根据题给化学工艺流程知,过程Ⅰ中,在Fe2+催化下,Pb、PbO2和H2SO4反应生成PbSO4和水;
(2)①催化剂通过参加反应,改变反应历程,降低反应的活化能,加快化学反应速率,而本身的质量和化学性质反应前后保持不变.根据题给信息知反应i中Fe2+被PbO2氧化为Fe3+,则反应ii中Fe3+被Pb还原为Fe2+,据此书写离子方程式;
②KSCN溶液与铁离子显红色:向酸化的亚铁离子中加入PbO2证明发生反应i,则再加入Pb证明发生反应ii,实验方案为取红色溶液少量,加入过量Pb,充分反应后,红色褪去;
(3)因为Ksp(PbSO4)=1.6×10-5,Ksp (PbCO3)=3.3×10-14,c(SO42-)=1.6mol•L-1,c(CO32-)=0.1mol•L-1,PbCO3中:c(Pb2+)=$\frac{Ksp(PbC{O}_{3})}{c(C{{O}_{3}}^{2-})}$=3.3×10-13,;PbSO4中:Q=c(Pb2+)×c(SO42-)=3.3×10-13×1.6=5.28×10-13<Ksp(PbSO4),说明PbSO4在母液中未饱和,即PbCO3中不混有PbSO4;
(4)①根据钠离子向阴极移动知,a为阴极,与电源负极相连;
②电解过程中,PbO2在阴极得电子,电极反应式为PbO2+4e-+2H2O=Pb+4OH-;
③钠离子交换膜只允许钠离子通过,阻止HPbO2-进入阳极室被氧化,从而提高Pb元素的利用率.
解答 解:(1)根据题给化学工艺流程知,过程Ⅰ中,在催化下,Pb、PbO2和H2SO4反应生成PbSO4和水,化学方程式为:Pb+PbO2+2H2SO4$\frac{\underline{\;Fe_{2}+\;}}{\;}$2PbSO4+2H2O;
故答案为:Pb+PbO2+2H2SO4$\frac{\underline{\;Fe_{2}+\;}}{\;}$2PbSO4+2H2O;
(2)①催化剂通过参加反应,改变反应历程,降低反应的活化能,加快化学反应速率,而本身的质量和化学性质反应前后保持不变.根据题给信息知反应i中Fe2+被PbO2氧化为Fe3+,则反应ii中Fe3+被Pb还原为Fe2+,离子方程式为:2Fe3++Pb+SO42-═PbSO4+2Fe2+;
故答案为:2Fe3++Pb+SO42-=PbSO4+2Fe2+;
②步骤1:向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,
步骤2:取步骤1中反应液少量,再加入少量PbO2,溶液变红,亚铁离子被氧化为铁离子,
步骤3:取步骤2中红色溶液少量,溶液中存在平衡,Fe3++3SCN-=Fe(SCN)3,加入过量Pb,和平衡状态下铁离子反应生成亚铁离子,平衡逆向进行充分反应后,红色褪去;
故答案为:
| 编号 | 实验操作 | 现象 |
| 步骤2 | 取步骤1中反应液少量,加入少量PbO2,充分反应 | 溶液变红 |
| 步骤3 | 取步骤2中反应液少量,加入足量Pb,充分反应 | 红色褪去 |
故答案为:否;
(4)①根据钠离子向阴极移动知,a为阴极,与电源负极相连;
故答案为:负;
②电解过程中,PbO2在阴极得电子,电极反应式为PbO2+4e-+2H2O=Pb+4OH-;
故答案为:PbO2+4e-+2H2O=Pb+4OH-;
③钠离子交换膜只允许钠离子通过,阻止HPbO2-进入阳极室被氧化,从而提高Pb元素的利用率;
故答案为:阻止HPbO2-进入阳极室被氧化.
点评 本题考查未知反应书写、溶度积、电化学及基础实验问题,是高考常见题型,向考生展示运用化学知识解决生产生活中的实际问题,题目难度较大.

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
已知:①软锰矿主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质.
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
③部分氢氧化物沉淀相关的溶液pH如表一:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
表二
| 实验序号 | SO2浓度(g•m-3) | 烟气流速(mL•min-1) |
| ① | 4.1 | 55 |
| ② | 4.1 | 96 |
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是H2O2(填化学式)
(3)加氨水调溶液pH在5~6之间,目的是除去铁、铝元素.
(4)锰酸锂可充电电池(图3)的总反应式为:Li1-xMnO4+LixC$?_{放电}^{充电}$ LiMnO4+C(x<1)
①放电时,电池的正极反应式为Li1-xMnO4+xLi++xe-=LiMn2O4
②充电时,若转移1mole-,则石墨电极将增重7g.
| A. | 聚乙烯、植物油都是混合物,都能使溴的四氯化碳溶液褪色 | |
| B. | 苯、溴水、铁粉混合制成溴苯 | |
| C. | 沸点:戊烷>丁烷>乙烷 | |
| D. | 由丙烯加溴制1,2-二溴丙烷 |
| A. | 投入足量漂白粉后的溶液中:Fe2+、H+、Cl-、SO42- | |
| B. | 0.1mol/LFeCl3溶液中:Na+、Ba2+、NO3-、SCN- | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol/L的溶液中:NH4+、Ca2+、Cl、NO3- | |
| D. | 水电离的c(OH-)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32- |
| A. | 44g CO2和N2O的混合物中含有的氧原子数为1.5NA | |
| B. | 2L 0.5mol/L亚硫酸氢钠溶液中含有的HSO3-离子数为NA | |
| C. | 0.5mol CH5+中含有的电子数目为5NA | |
| D. | 常温下,1L 0.5 mol/L Ba(OH)2溶液中水电离的OH-个数为0.1NA |
| 实验 | 现象 | 结论 | |
| A |  | 最后试管中出现白色沉淀 | 有机物中含 有氯原子 |
| B |  | 酸性高锰酸钾溶液褪色 | 浓硫酸有 吸水性 |
| C |  | 最后一滴标准液使酚酞由无色变为浅红色,且30s内不褪色 | 滴定达到 终点 |
| D |  | Na2SiO3溶液变浑浊 | 非金属性 Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |

| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象 | |
| C. | 实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动 | |
| D. | 饱和Na2CO3溶液可以降低乙酸乙酯的溶解度,并吸收蒸出的乙酸和乙醇 |
 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )| A. | 电池工作时,是将太阳能转化为电能 | |
| B. | 铜电极为正极,电极反应式为:CO2+8e-+8H+═CH4+2H2O | |
| C. | 电池内部H+透过质子交换膜从左向右移动 | |
| D. | 为提高该人工光合系统的工作效率,可向装置中加入少量硝酸溶液 |
