题目内容
下列有关叙述正确的是( )
| A、任何晶体中,若含有阳离子也一定含有阴离子 |
| B、金属键越强,则该金属的金属性越强 |
| C、金属钨的熔点高于金属钠,是因为钨的金属键更强 |
| D、金属导电的过程实质上就是金属键被破坏的过程,不能用“电子气理论”来解释 |
考点:不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:A.金属晶体含有阳离子,但不含阴离子;
B.金属性越强,金属键越弱;
C.金属键越强,熔点越高;
D.组成金属晶体的微粒为金属阳离子和自由电子,在外加电场作用下电子可发生定向移动,故能导电.
B.金属性越强,金属键越弱;
C.金属键越强,熔点越高;
D.组成金属晶体的微粒为金属阳离子和自由电子,在外加电场作用下电子可发生定向移动,故能导电.
解答:
解:A.金属晶体由金属离子和自由电子构成,含有阳离子,但不含阴离子,故A错误;
B.属性强的元素原子核对外层电子吸引力弱,外层电子更活跃,容易脱离原子,从而发生化学反应;金属键就是金属离子和自由电子的相互作用,故B错误;
C.金属键越强,熔点越高,故C正确;
D.组成金属晶体的微粒为金属阳离子和自由电子,在外加电场作用下电子可发生定向移动,故能导电,能用“电子气理论”来解释,故D错误.
故选C.
B.属性强的元素原子核对外层电子吸引力弱,外层电子更活跃,容易脱离原子,从而发生化学反应;金属键就是金属离子和自由电子的相互作用,故B错误;
C.金属键越强,熔点越高,故C正确;
D.组成金属晶体的微粒为金属阳离子和自由电子,在外加电场作用下电子可发生定向移动,故能导电,能用“电子气理论”来解释,故D错误.
故选C.
点评:本题考查不同晶体的结构微粒及微粒间作用力的区别,难度不大,注意基础知识的积累.

练习册系列答案
相关题目
下列属于电解质并能导电的物是( )
①熔融的NaCl ②KNO3溶液 ③Cu ④酒精 ⑤NaCl晶体 ⑥盐酸.
①熔融的NaCl ②KNO3溶液 ③Cu ④酒精 ⑤NaCl晶体 ⑥盐酸.
| A、① | B、①②③⑤⑥ |
| C、①②⑥ | D、①③④⑤ |
通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银):n(硝酸亚汞)=2:1,则下列叙述正确的是( )
| A、电解后溶液的pH都增大 |
| B、在两个阳极上得到的产物的物质的量不相等 |
| C、硝酸亚汞的分子式为Hg2(NO3)2 |
| D、在两个阴极上得到的银和汞的物质的量之比为2:1 |
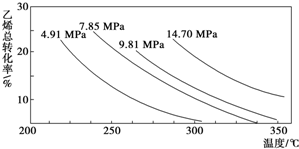 工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为CH2═CH2(g)+H2O(g)?CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等.如图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是( )
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为CH2═CH2(g)+H2O(g)?CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等.如图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是( )| A、合成乙醇的反应一定为放热反应 |
| B、目前工业上采用250~300℃,主要是因为在此温度下乙烯的转化率最大 |
| C、目前工业上采用加压条件(7 MPa左右),目的是提高乙醇的产率和加快反应速率 |
| D、相同催化剂下,在300℃14.70 MPa乙醇产率反而比300℃7.85 MPa低得多,是因为加压平衡向逆反应方向移动 |
下列各物质中,按熔点由高到低的顺序排列正确的是( )
| A、CH4>SiH4>GeH4>SnH4 |
| B、KCl>NaCl>NaF>LiF |
| C、Rb>K>Na>Li |
| D、金刚石>氯化钠>钠>干冰 |
下列有机物结构中,核磁共振氢谱不可能只有一个峰值的是( )
| A、C3H4 |
| B、C3H6 |
| C、C3H8 |
| D、C5H12 |
在5KCl+KClO3+3H2SO4═3Cl2↑+3K2SO4+3H2O中,被氧化与被还原的氯原子的物质的量比为( )
| A、5:1 | B、1:5 |
| C、1:1 | D、3:1 |