题目内容
17.向三份均为100mL0.5mol•L-1NaHCO3溶液中,分别加入少量冰醋酸、Ca(OH)2固体、NaAlO2固体(忽略溶液体积变化),则三份溶液中c(CO32-)的变化依次为( )| A. | 减小、减小、增大 | B. | 减小、增大、增大 | C. | 增大、减小、减小 | D. | 减小、增大、减小 |
分析 碳酸氢钠与醋酸反应生成醋酸钠、水、二氧化碳,碳酸氢钠与反应Ca(OH)2生成碳酸钙、碳酸钠、水,NaAlO2促进碳酸氢根离子的电离,以此来解答.
解答 解:冰醋酸电离出氢离子,发生HCO3-+H+=H2O+CO2↑,电离平衡正向移动,CO32-减少;
Ca(OH)2电离出OH-与H+结合,HCO3-?CO32-+H+平衡向右移动,CO32-增多;
由HCO3-?CO32-+H+、AlO2-+H2O+H+=Al(OH)3↓可知,HCO3-?CO32-+H+平衡向右移动,CO32-增多,
故选B.
点评 本题考查离子浓度的变化,为高频考点,把握发生的反应、电离平衡移动等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
7.将含有一摩尔Na2CO3的溶液逐滴入含有1.25molHCl的稀盐酸中,混合充分反应,产生气体V1,若将上述稀盐酸全部逐滴滴入Na2CO3溶液中,混合充分反应,产生气体V2.在相同条件下V1与V2之比为( )
| A. | 1:1 | B. | 2:5 | C. | 5:2 | D. | 2:3 |
8.下列关于有机物的说法正确的是( )
| A. | 乙烯和苯都能与溴水反应 | |
| B. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| C. | 有机物分子中都存在碳碳单键 | |
| D. | 乙醇可以被氧化为乙酸,二者都能发生酯化反应 |
5.下列反应不属于氮的固定反应是( )
| A. | N2+3Mg$\frac{\underline{\;点燃\;}}{\;}$Mg3N2 | B. | N2+3H2$?_{催化剂}^{高温、高压}$2NH3 | ||
| C. | 2NO+O2═2NO2 | D. | N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO |
12.常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2 气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3.有关叙述正确的是( )
| A. | 三种酸的电离常数:Ki1(H2CO3)>Ki(HX)>Ki(HY)>Ki2(H2CO3) | |
| B. | NaX溶液中通入足量CO2后的离子浓度:c(HCO3-)>c(CO32-)>c(X-) | |
| C. | 同浓度溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 | |
| D. | 结合H+的能力:Y->CO32->X->HCO3- |
2.下列有关硫元素及其化合物的表示正确的是( )
| A. | 中子数为18的硫离子:${\;}_{16}^{32}$S2- | |
| B. | S2-的结构示意图: | |
| C. | Na2O2的电子式:Na+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-Na+ | |
| D. | 亚硫酸的电离方程式:H2SO3?2H++SO32- |
9.下列水解离子方程式表达正确的是( )
| A. | NaClO溶液:ClO-+H2O═HClO+OH- | B. | FeCl3溶液:Fe3++3H2O?Fe(OH)3↓+3H+ | ||
| C. | Na2S溶液:S2-+H2O?H2S+2OH- | D. | NH4Cl溶液:NH4++H2O?NH3•H2O+H+ |
7.水煤气的组成是一氧化碳和氢气,它们可由水蒸气和灼热的焦炭反应制得.在该反应中,还原剂是( )
| A. | 氢气 | B. | 一氧化碳 | C. | 水蒸气 | D. | 焦炭 |
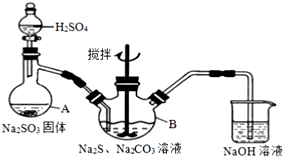 硫代硫酸钠(Na2S2O3)是一种重要的化工产品.某兴趣小组在查阅资料后制备Na2S2O3,结合其性质进行了实验探究.
硫代硫酸钠(Na2S2O3)是一种重要的化工产品.某兴趣小组在查阅资料后制备Na2S2O3,结合其性质进行了实验探究.