题目内容
12.常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2 气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3.有关叙述正确的是( )| A. | 三种酸的电离常数:Ki1(H2CO3)>Ki(HX)>Ki(HY)>Ki2(H2CO3) | |
| B. | NaX溶液中通入足量CO2后的离子浓度:c(HCO3-)>c(CO32-)>c(X-) | |
| C. | 同浓度溶液的碱性:NaX>Na2CO3>NaY>NaHCO3 | |
| D. | 结合H+的能力:Y->CO32->X->HCO3- |
分析 根据题意写出方程式:
CO2+H2O+NaX=HX+NaHCO3;HX+Na2CO3=NaHCO3+NaX;
CO2+H2O+2NaY=2HY+Na2CO3;NaHCO3+NaY=HY+Na2CO3;
利用强酸制弱酸的原理判断出酸性:H2CO3>HX>NaHCO3>HY,
碱性强弱可以利用越弱越水解判断:NaHCO3<NaX<Na2CO3<NaY,据此分析.
解答 解:A.向NaX溶液中通入CO2气体,只能生成HX和NaHCO3,则酸性H2CO3>HX>NaHCO3,向NaY溶液中通入CO2,只生成HY和Na2CO3,则酸性NaHCO3>HY,则有酸性由强到弱:H2CO3>HX>HCO3->HY,酸性越强,电离常数越大,所以三种酸的电离常数:Ki1(H2CO3)>Ki(HX)>Ki2(H2CO3)>Ki(HY),故A错误;
B.向NaX溶液中通入足量CO2后生成HX和NaHCO3,由于酸性HX>HCO3-,所以c(X-)>c(CO32-),则c(HCO3-)c(X-)>c(CO32-),故B错误;
C.酸性H2CO3>HX>NaHCO3>HY,碱性强弱可以利用越弱越水解判断,所以溶液的碱性:NaHCO3<NaX<Na2CO3<NaY,故C错误;
D.由A可知酸性H2CO3>HX>NaHCO3>HY,则结合质子能力:Y->CO32->X->HCO3-,故D正确.
故选D.
点评 本题考查离子浓度的大小比较,题目难度较大,注意根据通入二氧化碳的反应判断酸的强弱是解答该题的关键,做题时注意体会.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目
20.下列各组中的两种无色透明溶液,不能通过相互滴加鉴别的是( )
| A. | AlCl3、KOH | B. | KAlO2、HCl | C. | KHCO3、HNO3 | D. | Na2CO3、HCl |
7.设阿伏加德罗常数的值为NA,下列说法中正确的是( )
| A. | 1L0.1mol/L乙酸溶液中 H+数为0.1NA | |
| B. | 16g甲烷分子中所含质子数为10NA | |
| C. | 0.1molCnH2n+2中含有的C-C键数为0.1nNA | |
| D. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA |
17.向三份均为100mL0.5mol•L-1NaHCO3溶液中,分别加入少量冰醋酸、Ca(OH)2固体、NaAlO2固体(忽略溶液体积变化),则三份溶液中c(CO32-)的变化依次为( )
| A. | 减小、减小、增大 | B. | 减小、增大、增大 | C. | 增大、减小、减小 | D. | 减小、增大、减小 |
4.[实验化学]乙酰苯胺为无色晶体,有“退热冰”之称.其制备原理为:
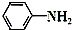 +CH3COOH$\stackrel{△}{→}$
+CH3COOH$\stackrel{△}{→}$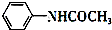 +H2O
+H2O
已知:①苯胺易被氧化; ②苯胺、醋酸和乙酰苯胺的部分物理性质如表:
制备乙酰苯胺的实验步骤如下:
步骤1:在下图1装置的圆底烧瓶中,加入6.0mL苯胺、9.0mL冰醋酸及0.2g锌粉.
步骤2:控制温度计示数约105℃,小火加热回流1h.
步骤3:趁热将反应混合物倒入盛有100mL冷水的烧杯中,抽滤,洗涤,得到粗产品.
步骤4:通过重结晶提纯粗产品后,获得无色片状晶体,干燥后得目标产品.
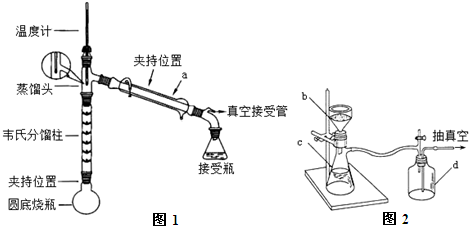
(1)仪器a的名称为冷凝管.
(2)步骤1中加入锌粉的作用是防止苯胺被氧化,同时起着沸石的作用.
(3)步骤2中控制温度计示数约105℃的原因是乙酸有挥发性,温度过高,乙酸蒸出,降低了反应物的利用率,而温度过低,不能除去反应生成水.
(4)步骤3中,抽滤装置如图2所示,仪器c的名称是吸滤瓶,当过滤的溶液具有强酸性、强碱性或强氧化性时要用玻璃纤维代替滤纸或用玻璃砂漏斗代替布氏漏斗,停止抽滤时的操作为先旋开安全瓶d上的旋塞恢复常压然后关闭抽气泵.
 +CH3COOH$\stackrel{△}{→}$
+CH3COOH$\stackrel{△}{→}$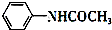 +H2O
+H2O已知:①苯胺易被氧化; ②苯胺、醋酸和乙酰苯胺的部分物理性质如表:
| 试剂名称 | 熔点℃ | 沸点℃ | 溶解度(20℃) |
| 苯胺 | -6.2 | 184.4 | 稍溶于水(3.4g),与乙醇、乙醚、苯混溶 |
| 乙酸 | 16.7 | 118 | 易溶于水、乙醇、乙醚等 |
| 乙酰苯胺 | 114~116 | 280~290 | 0.46g |
步骤1:在下图1装置的圆底烧瓶中,加入6.0mL苯胺、9.0mL冰醋酸及0.2g锌粉.
步骤2:控制温度计示数约105℃,小火加热回流1h.
步骤3:趁热将反应混合物倒入盛有100mL冷水的烧杯中,抽滤,洗涤,得到粗产品.
步骤4:通过重结晶提纯粗产品后,获得无色片状晶体,干燥后得目标产品.

(1)仪器a的名称为冷凝管.
(2)步骤1中加入锌粉的作用是防止苯胺被氧化,同时起着沸石的作用.
(3)步骤2中控制温度计示数约105℃的原因是乙酸有挥发性,温度过高,乙酸蒸出,降低了反应物的利用率,而温度过低,不能除去反应生成水.
(4)步骤3中,抽滤装置如图2所示,仪器c的名称是吸滤瓶,当过滤的溶液具有强酸性、强碱性或强氧化性时要用玻璃纤维代替滤纸或用玻璃砂漏斗代替布氏漏斗,停止抽滤时的操作为先旋开安全瓶d上的旋塞恢复常压然后关闭抽气泵.
2.在一定温度下的定容密闭容器中,发生反应:2NO2(g)?N2O4(g).当下列所给有关量不再变化时,不能表明该反应已达平衡状态的是( )
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | 混合气体的平均相对分子质量 | D. | $\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$ |
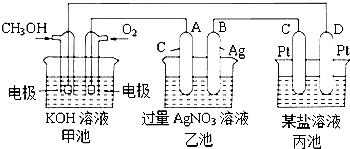 图是一个化学过程的示意图.
图是一个化学过程的示意图.
 (或碳碳双键).
(或碳碳双键). .
. .
. 为起始原料制备
为起始原料制备 的合成路线
的合成路线 .
.