题目内容
6.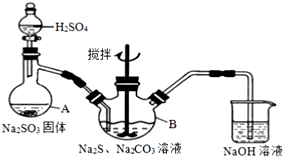 硫代硫酸钠(Na2S2O3)是一种重要的化工产品.某兴趣小组在查阅资料后制备Na2S2O3,结合其性质进行了实验探究.
硫代硫酸钠(Na2S2O3)是一种重要的化工产品.某兴趣小组在查阅资料后制备Na2S2O3,结合其性质进行了实验探究.【查阅资料】
工业上常将SO2气体通入Na2S和Na2CO3的混合溶液中制取Na2S2O3.
【实验探究】
实验一:Na2S2O3的制备
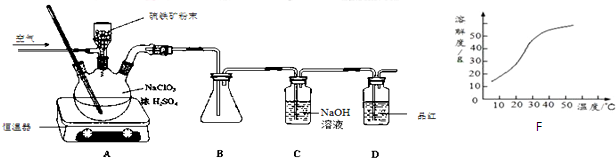
兴趣小组模拟工业制法制备Na2S2O3,其反应装置及所需试剂如图.
(1)仪器A的名称蒸馏烧瓶.
(2)仪器B中,若反应时硫原子的利用率为100%,且有无色无味气体生成,则发生反应的总反应方程式是4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2.
(3)待Na2S和Na2CO3完全消耗后,结束反应,B中混合液经蒸发、结晶、过滤、洗涤、干燥得粗产品.
实验二:Na2S2O3 样品纯度的测定
(4)利用反应:I2+2Na2S2O3=Na2S4O6+2NaI,可以定量测定硫代硫酸钠样品的纯度(不考虑杂质与I2反应).称取wg硫代硫酸钠固体样品,配成250mL溶液,取25.00mL 置于锥形瓶中,加入几滴淀粉溶液作指示剂,用amol/L的碘水作标准液进行滴定,消耗碘水bmL.
①盛装碘水的滴定管是a(填字母编号).a.酸式滴定管 b.碱式滴定管
②滴定达到终点时的现象是溶液刚好出现蓝色,且半分钟不褪去.
③计算样品中硫代硫酸钠纯度的表达式为$\frac{3.16ab}{w}$×100%.
分析 (1)根据装置图可知仪器名称;
(2)仪器B中为硫酸钠、碳酸钠及二氧化硫反应生成硫代硫酸钠,根据硫原子的利用率为100%,且有无色无味气体生成应为二氧化碳,根据元素守恒可书写化学方程式;
(3)将生成硫代硫酸钠的混合溶液经过蒸发、结晶、过滤、洗涤、干燥可得粗产品;
(4)①单质碘具有氧化性,能氧化腐蚀橡胶;
②淀粉遇到单质碘变蓝色,根据溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
③求出硫代硫酸钠的质量,样品中硫代硫酸钠纯度=$\frac{m(Na{\;}_{2}S{\;}_{2}O{\;}_{3})}{m(样品)}$×100%.
解答 解:(1)根据装置图可知仪器A的名称为蒸馏烧瓶,
故答案为:蒸馏烧瓶;
(2)仪器B中为硫酸钠、碳酸钠及二氧化硫反应生成硫代硫酸钠,根据硫原子的利用率为100%,且有无色无味气体生成应为二氧化碳,所以发生反应的总反应方程式是4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2,
故答案为:4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2;
(3)将生成硫代硫酸钠的混合溶液经过蒸发、结晶、过滤、洗涤、干燥可得粗产品,
故答案为:洗涤;
(4)①单质碘具有氧化性,能氧化腐蚀橡胶,需要选取酸式滴定管,故选a;
②淀粉遇到单质碘变蓝色,所以滴定终点的现象为溶液刚好出现蓝色,且半分钟不褪去;
故答案为:溶液刚好出现蓝色,且半分钟不褪去;
③根据I2+2Na2S2O3=Na2S4O6+2NaI,n(I2)=amol/L×b×10-3L,知消耗的Na2S2O3的物质的量=2n(I2)=2amol/L×b×10-3L,根据现称取Wg硫代硫酸钠固体样品配成250mL的溶液,取25.00mL置于锥形瓶中,则被滴定的硫代硫酸钠质量为$\frac{1}{10}$Wg,故样品中硫代硫酸钠纯度的表达式为$\frac{2amol/L×b×10{\;}^{-3}L×158g/mol}{\frac{1}{10}wg}$×100%=$\frac{3.16ab}{w}$×100%;
故答案为:$\frac{3.16ab}{w}$×100%.
点评 本题考查了物质百分含量的探究,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.

(1)已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g)?CH3OH(g)△H1.如表所列为常见化学键的键能数据:
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | 348 | 414 | 436 | 326.8 | 1032 | 464 |
(2)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.已知利用焦炉气合成二甲醚的三步反应如下:
ⅰ.2H2(g)+CO(g)?CH3OH(g)△H1
ⅱ.2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
ⅲ.CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.3kJ•mol-1
①总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=-322.4kJ•mol-1.
②下列描述中能说明上述总反应已达平衡的是C.
A.c(H2)、c(CO)、c(CH3OCH3)、c(CO2)均为0.1mol•L-1
B.2v(H2)正=v(CH3OCH3)逆
C.容器中气体的压强保持不变
D.单位时间内生成n mol CO的同时生成n mol H2
③一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是ace.
a.增大压强 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(3)①甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理示意图如图甲,该燃料电池的电池反应式为2CH3OH (g)+3O2(g)═2CO2(g)+4H2O(l),则正极的电极反应式为4H++4e-+O2=2H2O.
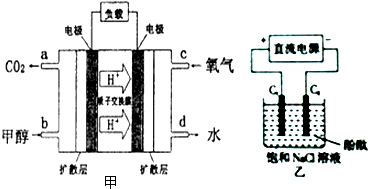
②用上述电池做电源,用图乙装置电解饱和食盐水(C1、C2均为石墨电极),该反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ 2OH-+Cl2↑+H2↑,电解初始在电极C2(填“C1”或“C2”)的周围先出现红色.
③当有8g甲醇完全反应,在C2上可收集到标准状况下气体的体积为16.8L.
| A. | 减小、减小、增大 | B. | 减小、增大、增大 | C. | 增大、减小、减小 | D. | 减小、增大、减小 |
| A. | 除去混在NO2中的NO:将气体与足量O2混合 | |
| B. | 除去混在CO2中的SO2:将气体依次通过足量酸性KMnO4溶液和浓硫酸 | |
| C. | 除去KCl溶液中的K2CO3:加入过量BaCl2溶液后过滤 | |
| D. | 除去乙酸中混有的乙醇:加入金属钠后蒸馏 |
| A. | Zn电极上发生的反应为:2H++2e-═H2↑ | |
| B. | H+向Zn电极移动 | |
| C. | 溶液的c(H+)减小 | |
| D. | 电子由Cu转移到Zn |
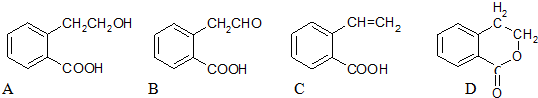

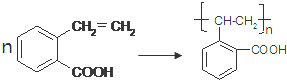 .
.