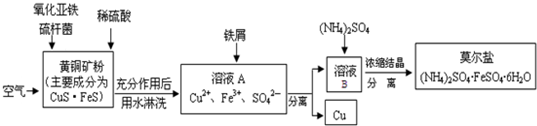
题目内容
反应C(s)+H2O(g)?CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎没影响的是( )
| A、增加C的量 |
| B、将容器的体积缩小一半 |
| C、投入一块钠 |
| D、保持压强不变,充入Ar使容器容积变大 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:影响反应速率的因素有温度、浓度、压强、催化剂和固体的接触面积等,据此分析:
A、固体量的增减不影响反应速率;
B、体积缩小,反应体系中物质的浓度增大,化学反应速率越快;
C、Na能够与水蒸气反应,是其浓度降低;
D、压强不变,充入氮气容器的体积变大,反应体系中各物质的浓度减小.
A、固体量的增减不影响反应速率;
B、体积缩小,反应体系中物质的浓度增大,化学反应速率越快;
C、Na能够与水蒸气反应,是其浓度降低;
D、压强不变,充入氮气容器的体积变大,反应体系中各物质的浓度减小.
解答:
解:A、因浓度越大,化学反应速率越快,但是固体量的增减不影响反应速率,所以增加C(s)的量,反应速率不变,故A正确;
B、将容器的体积缩小一半,反应体系中物质的浓度增大,则化学反应速率增大,故B错误;
C、Na能够与水蒸气反应,使其浓度降低,反应速率减慢,故C错误;
D、保持压强不变,充入氮气,使容器的体积变大,反应体系中各物质的浓度减小,则反应速率减小,故D错误.
故选A.
B、将容器的体积缩小一半,反应体系中物质的浓度增大,则化学反应速率增大,故B错误;
C、Na能够与水蒸气反应,使其浓度降低,反应速率减慢,故C错误;
D、保持压强不变,充入氮气,使容器的体积变大,反应体系中各物质的浓度减小,则反应速率减小,故D错误.
故选A.
点评:本题考查了影响化学速率的因素,需要注意的是改变纯固体或液体的量,对反应速率无影响,压强改变必须引起浓度的改变才能引起化学反应速率的改变.

练习册系列答案
相关题目
利用如图所示实验装置测定气体摩尔体积,所用药品为1g锌粒和10mL 0.5mol?L-1硫酸溶液,相关叙述正确的是( )
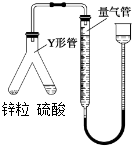

| A、实验时,将硫酸溶液倾斜倒入锌粒中 |
| B、实验时,量气管压入漏斗的水过多而溢出,不影响实验 |
| C、实验时,待体系温度降低到0℃时方可进行读数 |
| D、实验时,用CCl4代替水,测得氢气的体积更准确 |
已知0.1mol?L-1CH3COOH溶液的pH=3,溶液中存在CH3COOH?CH3COO-+H+,下列有关说法正确的是( )
A、加水稀释,溶液中
| ||
| B、加水稀释100倍时,溶液的pH=5 | ||
| C、升温或加入少量NaOH(s)均促进电离,其电离常数不变 | ||
| D、加NaOH溶液,当混合液的pH=7时,溶液中c(Na+)=c(CH3COO-) |
 如图表示反应X(g)═4Y(g)+Z(g)△H<0,在某温度时X的浓度
如图表示反应X(g)═4Y(g)+Z(g)△H<0,在某温度时X的浓度随时间变化的曲线.下列有关该反应的描述正确的是( )
| A、该反应的过程是熵减小的过程 |
| B、若降低温度,v正减小,v逆增大 |
| C、第6min后,反应就停止了 |
| D、X在第一分钟和第二分钟内的平均反应速率之比是3:2 |
某温度下,C和H2O(g)在密闭容器里发生下列反应:C(s)+H2O(g)?CO(g)+H2(g),CO(g)+H2O(g)?CO2(g)+H2(g),达到平衡时,c(H2)=1.9mol?L-1,c(CO)=0.1mol?L-1.则下列叙述正确的有( )
| A、CO在平衡时转化率为10% |
| B、其他条件不变,缩小体积,H2O(g)的转化率降低 |
| C、平衡浓度c(CO2)=c(H2) |
| D、平衡时气体平均相对分子质量约为23.3 |
国家发改委、中宣部等十七部委在人民大会堂举行“节能减排全民行动”启动仪式,要求在全国范围内形成全民节能减排氛围.下列有关做法不符合这一要求的是( )
| A、推进小火力发电站的兴建,缓解地方用电困难,促进地方经济的发展 |
| B、推广“低碳经济”,减少温室气体的排放 |
| C、推广“绿色自由”计划,吸收空气中的CO2并利用廉价能源合成汽油 |
| D、利用晶体硅制作的太阳能电池可将太阳能直接转化为电能 |
某无色透明、强酸性溶液中一定能大量共存的离子是( )
| A、Fe2+、Na+、NO3-、OH- |
| B、K+、Ca2+、Cl-、NO3- |
| C、K+、NH4+、ClO-、HCO3- |
| D、Ba2+、Na+、SO32-、SiO32- |
已知98%的浓H2SO4的密度为1.84g/ml,现将40ml该硫酸用等体积的水进行稀释,所得硫酸的质量分数浓度为( )
| A、等于49% | B、大于49% |
| C、小于49% | D、无法判断 |