题目内容
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| 化学式 | 电离常数 |
| HClO | Ki=3×10-8 |
| H2CO3 | Ki1=4.3×10-7 |
| Ki2=5.6×10-11 |
| A、c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) |
| B、c(ClO-)>c(HCO3-)>c(OH-)>c(H+) |
| C、c(HCO3-)>c(ClO-)>c(OH-)>c(H+) |
| D、c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A、根据氯元素和碳元素总量相等判断;
B、根据电离常数判断两物质水解程度,进而比较离子浓度大小;
C、根据电离常数判断两物质水解程度,进而比较离子浓度大小;
D、根据电荷守恒判断.
B、根据电离常数判断两物质水解程度,进而比较离子浓度大小;
C、根据电离常数判断两物质水解程度,进而比较离子浓度大小;
D、根据电荷守恒判断.
解答:
解:A、根据氯元素和碳元素总量相等可知,c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-),故A错误;
B、根据电离常数可知,次氯酸根的水解程度大于碳酸氢根,所以溶液中c(HCO3-)>c(ClO-),故B错误;
C、根据电离常数可知,次氯酸根的水解程度大于碳酸氢根,所以溶液中c(HCO3-)>c(ClO-),两物质水解都呈碱性,且水解程度都比较小,所以c(HCO3-)>c(ClO-)>c(OH-)>c(H+),故C正确;
D、根据电荷守恒,c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)+2c(CO32-),故D错误;
故选C.
B、根据电离常数可知,次氯酸根的水解程度大于碳酸氢根,所以溶液中c(HCO3-)>c(ClO-),故B错误;
C、根据电离常数可知,次氯酸根的水解程度大于碳酸氢根,所以溶液中c(HCO3-)>c(ClO-),两物质水解都呈碱性,且水解程度都比较小,所以c(HCO3-)>c(ClO-)>c(OH-)>c(H+),故C正确;
D、根据电荷守恒,c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)+2c(CO32-),故D错误;
故选C.
点评:本题主要考查了强碱弱酸盐的水解,并根对应酸的电离常数判断水解程度的大小,中等难度,解题时注意盐类水解规律的应用.

练习册系列答案
相关题目
下列说法中正确的是( )
①锂在空气中燃烧生成的Li2O
②Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
③盐酸既有氧化性又有还原性
④Fe(OH)3、FeCl2、H2SiO3都不能直接用化合反应制备
⑤SO2能使酸性高锰酸钾溶液褪色,所以它具有漂白性.
①锂在空气中燃烧生成的Li2O
②Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
③盐酸既有氧化性又有还原性
④Fe(OH)3、FeCl2、H2SiO3都不能直接用化合反应制备
⑤SO2能使酸性高锰酸钾溶液褪色,所以它具有漂白性.
| A、②③④ | B、①②③ |
| C、①③ | D、①② |
利用如图所示实验装置测定气体摩尔体积,所用药品为1g锌粒和10mL 0.5mol?L-1硫酸溶液,相关叙述正确的是( )
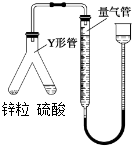

| A、实验时,将硫酸溶液倾斜倒入锌粒中 |
| B、实验时,量气管压入漏斗的水过多而溢出,不影响实验 |
| C、实验时,待体系温度降低到0℃时方可进行读数 |
| D、实验时,用CCl4代替水,测得氢气的体积更准确 |
在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A、无色溶液:Ca2+、H+、Cl-、HSO3 - | ||
| B、能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3 - | ||
| C、Na2CO3溶液:K+、Fe3+、SO42-、NO3 - | ||
D、
|
已知0.1mol?L-1CH3COOH溶液的pH=3,溶液中存在CH3COOH?CH3COO-+H+,下列有关说法正确的是( )
A、加水稀释,溶液中
| ||
| B、加水稀释100倍时,溶液的pH=5 | ||
| C、升温或加入少量NaOH(s)均促进电离,其电离常数不变 | ||
| D、加NaOH溶液,当混合液的pH=7时,溶液中c(Na+)=c(CH3COO-) |
 如图表示反应X(g)═4Y(g)+Z(g)△H<0,在某温度时X的浓度
如图表示反应X(g)═4Y(g)+Z(g)△H<0,在某温度时X的浓度随时间变化的曲线.下列有关该反应的描述正确的是( )
| A、该反应的过程是熵减小的过程 |
| B、若降低温度,v正减小,v逆增大 |
| C、第6min后,反应就停止了 |
| D、X在第一分钟和第二分钟内的平均反应速率之比是3:2 |
国家发改委、中宣部等十七部委在人民大会堂举行“节能减排全民行动”启动仪式,要求在全国范围内形成全民节能减排氛围.下列有关做法不符合这一要求的是( )
| A、推进小火力发电站的兴建,缓解地方用电困难,促进地方经济的发展 |
| B、推广“低碳经济”,减少温室气体的排放 |
| C、推广“绿色自由”计划,吸收空气中的CO2并利用廉价能源合成汽油 |
| D、利用晶体硅制作的太阳能电池可将太阳能直接转化为电能 |
已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图,下列说法正确的是( )
| X | Y |
| Z | W |
| A、非金属性:X<Y<Z |
| B、W的原子序数可能是Y的原子序数的2倍 |
| C、气态氢化物稳定性:Y<W |
| D、Z的化学活泼性一定比X 强 |