题目内容
16.如表所示的四种短周期元素W、X、Y、Z,这四种元素的原子最外层电子数之和为22.下列说法错误的是( )| X | Y | ||
| W | Z |
| A. | X、Y和氢形成的化合物中可能既有离子键、又有共价键 | |
| B. | X、Y、Z三种元素最低价氢化物的沸点HZ最高 | |
| C. | W元素的单质是良好的半导体材料,它与Z元素可形成化合物WZ4 | |
| D. | 物质W3X4中,每个原子最外层均达到8电子稳定结构 |
分析 四种短周期元素W、X、Y、Z的原子最外层电子数之和为22,由元素在周期表中位置可知,X处于第二周期,W、Y、Z处于第三周期,设W的最外层电子数为x,则X、Y、Z最外层电子数分别为x+1、x+2、x+3,则x+x+1+x+2+x+3=22,解得:x=4,故W为Si、X为N、Y为S、Z为Cl,据此结合元素周期律知识解答.
解答 解:由上述分析可知,W为Si、X为N、Y为S、Z为Cl,
A.X为N、Y为S,N、S和氢三种元素形成的化合物硫化铵中可能既有离子键、又有共价键,故A正确;
B.X的氢化物分子间含氢键,HX的沸点最高,故B错误;
C.W元素的单质为Si,Si单质是良好的半导体材料,Si它与Cl元素可形成化合物SiCl4,故C正确;
D.W3X4为Si3N4,Si周围有4个N,N原子周围有3个Si,该化合物中Si、N原子的最外层均达到8电子稳定结构,故D正确;
故选B.
点评 本题考查位置、结构与性质关系的应用,为高频考点,把握元素的位置、最外层电子数来推断元素为解答关键,侧重分析与应用能力的考查,注意常见元素及其化合物性质的应用,题目难度中等.

练习册系列答案
相关题目
6.下列有关叙述不正确的是( )
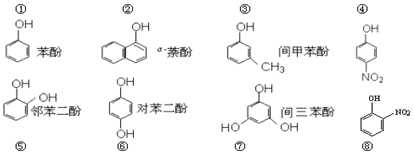
⑨HNO3 ⑩NH3.

⑨HNO3 ⑩NH3.
| A. | 能形成分子内氢键的有⑤⑧⑨ | |
| B. | 能形成分子间氢键有①②③④⑥⑦⑩ | |
| C. | 根据氢键形成的条件,可以推测还有元素Li的原子可以代替氢原子而形成类似氢键的结构 | |
| D. | C2H6O分子中同时存在极性键、非极性键和氢键 |
7.在25℃、101kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、670.3kJ/mol,则2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
| A. | -688.3 kJ/mol | B. | -488.3 kJ/mol | C. | -191 kJ/mol | D. | +488.3 kJ/mol |
11.化学实验的基本操作是完成化学实验的关键,下列实验操作正确的是( )
①用50mL量筒量取5.2mL稀硫酸;②用分液漏斗分离苯和四氯化碳的混合物;
③用托盘天平称量117.7g氯化钠晶体;④用量筒量取23.10mL溴水;
⑤用蒸发皿高温灼烧石灰石;⑥用250mL容量瓶配制250mL 0.2mol•L-1的NaOH溶液.
①用50mL量筒量取5.2mL稀硫酸;②用分液漏斗分离苯和四氯化碳的混合物;
③用托盘天平称量117.7g氯化钠晶体;④用量筒量取23.10mL溴水;
⑤用蒸发皿高温灼烧石灰石;⑥用250mL容量瓶配制250mL 0.2mol•L-1的NaOH溶液.
| A. | ③⑥ | B. | ②③④⑤ | C. | ①②④ | D. | ②⑤⑥ |
1.下列说法或表示法正确的是( )
| A. | 由“C(s,石墨)→C(s,金刚石)△H=+119kJ•mol-1”可知金刚石比石墨稳定 | |
| B. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O (1)△H=-285.8kJ•mol-1 | |
| C. | 在101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 | |
| D. | 等量的磷蒸气和磷固体分别完全燃烧,前者放出的热量多 |
18.分子式为C10H14的有机物,结构中苯环上有3个取代基的同分异构体有( )种.
| A. | 3种 | B. | 6种 | C. | 8种 | D. | 10种 |
 ①根据图所示,写出反应的热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41 kJ/mol.
①根据图所示,写出反应的热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41 kJ/mol.