题目内容
4. ①根据图所示,写出反应的热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41 kJ/mol.
①根据图所示,写出反应的热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41 kJ/mol.②已知16g固体硫完全燃烧时放出148.4kJ的热量,该反应的热化学方程式是:S(s)+O2(g)═SO2(g)△H=-296.8 kJ/mol.
分析 ①由图可知,反应物总能量大于生成物总能量,为放热反应,焓变为负,结合物质的状态书写热化学方程式;
②16g固体硫完全燃烧时放出148.4kJ的热量,S的物质的量为$\frac{16g}{32g/mol}$=0.5mol,则1molS(s)完全燃烧时放出热量为$\frac{148.4kJ}{0.5}$=296.8kJ,焓变为负,结合物质的状态书写热化学方程式.
解答 解:①由图可知,反应物总能量大于生成物总能量,为放热反应,焓变为负,结合物质的状态可知热化学方程式为CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41 kJ/mol,故答案为:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41 kJ/mol;
②16g固体硫完全燃烧时放出148.4kJ的热量,S的物质的量为$\frac{16g}{32g/mol}$=0.5mol,则1molS(s)完全燃烧时放出热量为$\frac{148.4kJ}{0.5}$=296.8kJ,焓变为负,结合物质的状态可知热化学方程式为S(s)+O2(g)═SO2(g)△H=-296.8 kJ/mol,
故答案为:S(s)+O2(g)═SO2(g)△H=-296.8 kJ/mol.
点评 本题考查热化学方程式的书写,为高频考点,把握反应中能量变化、焓变的正负、物质的状态为解答的关键,侧重分析与应用能力的考查,注意热化学方程式的书写方法,题目难度不大.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
14.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
| A. | 消耗的氧化剂n(HNO3):两者相同 | |
| B. | 消耗硝酸的物质的量:前者多,后者少 | |
| C. | 反应生成气体的颜色:前者浅,后者深 | |
| D. | 反应中转移的电子总数:前者多,后者少 |
15.下列有关实验操作、发生的现象、解释或结论都正确的是( )
| 选项 | 实验操作 | 产生的现象 | 解释或结论 |
| A | 向Na2SO3溶液中逐滴加入硝酸酸化的硝酸钡溶液 | 产生白色沉淀 | 产生的BaSO3是难溶于水的沉淀 |
| B | 将SO2通入滴有酸性高锰酸钾溶液中 | 溶液紫红色褪去 | SO2具有漂白性 |
| C | 常温下铜片插入硝酸中 | 产生红棕色气体 | 常温下铜和硝酸一定产生NO |
| D | 向某溶液中加入NaHCO3 | 产生白色沉淀 | 该溶液可能原来含有氢氧化钡 |
| A. | A | B. | B | C. | C | D. | D |
12.已知Na、Mg、Al为第三周期原子序数递增的元素,则下列说法正确的是( )
| A. | 金属活泼性:Na<Mg<Al | B. | 碱性:NaOH>Al(OH)3>Mg(OH)2 | ||
| C. | 原子半径:Na<Mg<Al | D. | 与水反应的剧烈程度:Na>Mg>Al |
19.下列有关有机物的说法正确的是( )
| A. | 氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| B. | C2H6O2与C3H6O2一定属于同系物 | |
| C. | 苯可以与溴水、高锰酸钾溶液反应而使它们褪色 | |
| D. | CH3CH218OH和CH3COOH反应生成的水的相对分子质量为18 |
9. 甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
 甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 乙的单质在空气中燃烧生成只含离子键的化合物 | |
| C. | 丙与庚的原子核外电子数相差11 | |
| D. | 原子半径:辛>己>戊 |
16.如表所示的四种短周期元素W、X、Y、Z,这四种元素的原子最外层电子数之和为22.下列说法错误的是( )
| X | Y | ||
| W | Z |
| A. | X、Y和氢形成的化合物中可能既有离子键、又有共价键 | |
| B. | X、Y、Z三种元素最低价氢化物的沸点HZ最高 | |
| C. | W元素的单质是良好的半导体材料,它与Z元素可形成化合物WZ4 | |
| D. | 物质W3X4中,每个原子最外层均达到8电子稳定结构 |
13.半导体工业用石英砂作原料通过三个重要反应生产单质硅.
①SiO2(s)(石英砂)+2C(s)=Si(s)(粗硅)+2CO(g)△H=+682.44kJ•mol-1
②Si(s)(粗硅)+2Cl2(g)=SiCl4(1)△H2=-657.01kJ•mol-1
③SiCl(1)+2Mg(s)=2MgCl2(s)+Si(s)(纯硅)△H3=-625.63kJ•mol-1
生产1.00kg纯硅放出的热量为( )
①SiO2(s)(石英砂)+2C(s)=Si(s)(粗硅)+2CO(g)△H=+682.44kJ•mol-1
②Si(s)(粗硅)+2Cl2(g)=SiCl4(1)△H2=-657.01kJ•mol-1
③SiCl(1)+2Mg(s)=2MgCl2(s)+Si(s)(纯硅)△H3=-625.63kJ•mol-1
生产1.00kg纯硅放出的热量为( )
| A. | 24372.86 kJ | B. | 21.44 kJ | C. | 600.20 kJ | D. | 21435.71 kJ |
6.下列各对物质中属于同分异构体的是( )
| A. | ${\;}_6^{12}$C与${\;}_6^{13}$C | B. | O2与O3 | ||
| C. |  与 与 | D. | 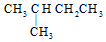 与 与 |