题目内容
18.分子式为C10H14的有机物,结构中苯环上有3个取代基的同分异构体有( )种.| A. | 3种 | B. | 6种 | C. | 8种 | D. | 10种 |
分析 分子式为C10H14的有机物,结构中苯环上有3个取代基,说明物质为苯的同系物,含一个苯环,苯环上三个取代基为:两个甲基,一个乙基,在苯环上的连接顺序不同得到不同的结构,据此计算同分异构体.
解答 解:分子式为C10H14的有机物,结构中苯环上有3个取代基,说明物质为苯的同系物,含一个苯环,苯环上三个取代基为:两个甲基,一个乙基,存在的同分异构体为: ,共计6种,
,共计6种,
故选B.
点评 本题考查了同分异构体书写方法,主要是苯同系物的取代基连接顺序,掌握基础是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.如表所示的四种短周期元素W、X、Y、Z,这四种元素的原子最外层电子数之和为22.下列说法错误的是( )
| X | Y | ||
| W | Z |
| A. | X、Y和氢形成的化合物中可能既有离子键、又有共价键 | |
| B. | X、Y、Z三种元素最低价氢化物的沸点HZ最高 | |
| C. | W元素的单质是良好的半导体材料,它与Z元素可形成化合物WZ4 | |
| D. | 物质W3X4中,每个原子最外层均达到8电子稳定结构 |
9. 水是生命的源泉、工业的血液、城市的血脉.要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请回答下列问题:
水是生命的源泉、工业的血液、城市的血脉.要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请回答下列问题:
(1)纯水在T℃时,pH=6,该温度下1mol•L-1的NaOH溶液中,由水电离出的c(OH-)=10-12 mol•L-1.
(2)25℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其主要水解反应的离子方程式为CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,由水电离出的c(OH-)=0.001mol•L-1.
(3)体积均为100mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数小于(填“大于”“小于”或“等于”)CH3COOH的电离平衡常数.理由是稀释相同倍数,一元酸HX的pH变化量比CH3COOH的小,故酸性较弱,电离平衡常数较小.
(4)电离平衡常数是衡量弱电解质电离程度的物理量.已知:
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三溶液的pH由大到小的顺序为Na2CO3溶液>NaCN溶液>CH3COONa溶液(用化学式表示).
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确值),c(CH3COO-)/c(CH3COOH)=18.
 水是生命的源泉、工业的血液、城市的血脉.要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请回答下列问题:
水是生命的源泉、工业的血液、城市的血脉.要保护好河流,因为河水是主要的饮用水源,污染物通过饮用水可直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请回答下列问题:(1)纯水在T℃时,pH=6,该温度下1mol•L-1的NaOH溶液中,由水电离出的c(OH-)=10-12 mol•L-1.
(2)25℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其主要水解反应的离子方程式为CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,由水电离出的c(OH-)=0.001mol•L-1.
(3)体积均为100mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数小于(填“大于”“小于”或“等于”)CH3COOH的电离平衡常数.理由是稀释相同倍数,一元酸HX的pH变化量比CH3COOH的小,故酸性较弱,电离平衡常数较小.
(4)电离平衡常数是衡量弱电解质电离程度的物理量.已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(填精确值),c(CH3COO-)/c(CH3COOH)=18.
6.下列各对物质中属于同分异构体的是( )
| A. | ${\;}_6^{12}$C与${\;}_6^{13}$C | B. | O2与O3 | ||
| C. |  与 与 | D. | 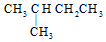 与 与 |
13.下列有机物中不能发生银镜反应的是( )
| A. | 麦芽糖 | B. | 乙酸 | C. | 甲酸甲酯 | D. | 乙醛 |
3.将二氧化硫通入下列试剂,能依次证明SO2具有还原性、漂白性、氧化性、酸性氧化物性质的是( )
①溴水
②品红溶液
③酸性高锰酸钾溶液
④硝酸钡溶液
⑤含酚酞的氢氧化钠溶液
⑥氢硫酸
⑦紫色石蕊试液
⑧氯化铁溶液.
①溴水
②品红溶液
③酸性高锰酸钾溶液
④硝酸钡溶液
⑤含酚酞的氢氧化钠溶液
⑥氢硫酸
⑦紫色石蕊试液
⑧氯化铁溶液.
| A. | ①⑤⑥④ | B. | ⑧②⑥⑤ | C. | ③⑦⑥⑤ | D. | ④②⑤① |
10.用石油和煤可以得到有机化工生产中需要的众多原料,例如由石油得到的乙烯和由煤得到的苯制聚苯乙烯.生产过程如下:
①CH2═CH2+ →
→
② $\stackrel{-H_{2}}{→}$
$\stackrel{-H_{2}}{→}$ 
③ →
→
下列说法不正确的是( )
①CH2═CH2+
 →
→
②
 $\stackrel{-H_{2}}{→}$
$\stackrel{-H_{2}}{→}$ 
③
 →
→
下列说法不正确的是( )
| A. | 通过裂解可以从石油中获得更多的乙烯 | |
| B. | 把煤干馏可以得到粗苯,经分馏可以得到苯 | |
| C. | 制聚苯乙烯的反应①为取代反应,②为消去反应③为加聚反应 | |
| D. | 反应①②③的原子利用率不都为100% |
2.有关氧化还原反应的叙述正确的是( )
| A. | 有单质参加或有单质生成的化学反应一定是氧化还原反应 | |
| B. | 有单质生成的分解反应属于氧化还原反应 | |
| C. | 没有单质参加的化合反应一定是非氧化还原反应 | |
| D. | 氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原 |
 已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如图,则硼氮苯的二氯取代物B2N3H4Cl2的同分异构的数目为( )
已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如图,则硼氮苯的二氯取代物B2N3H4Cl2的同分异构的数目为( )